
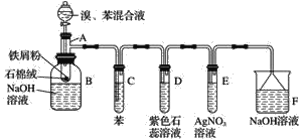
【题目】苯和液溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑。填写下列空白:
(1)写出A中主要反应的化学方程式:___________
(2)试管C中苯的作用是______________。反应开始后,观察试管D和试管E,看到的现象分别为D____________E____________。
(3)仪器B中的NaOH溶液的作用是____________,可观察到的现象是________。
(4)在上述整套装置中,具有防倒吸作用的装置有__________(填字母)。
【答案】![]() +Br2
+Br2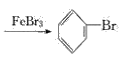 +HBr 除去HBr气体中混有的溴蒸气 紫色石蕊溶液慢慢变红,并在导管口有白雾产生 出现浅黄色沉淀 除去溶于溴苯中混有的溴,便于观察溴苯的颜色 在溶液底部有无色油状液体 DEF
+HBr 除去HBr气体中混有的溴蒸气 紫色石蕊溶液慢慢变红,并在导管口有白雾产生 出现浅黄色沉淀 除去溶于溴苯中混有的溴,便于观察溴苯的颜色 在溶液底部有无色油状液体 DEF
【解析】
由实验装置可知,A中苯与液溴发生取代反应生成溴苯、HBr,B中溴苯与NaOH溶液分层,且溴苯在下层,C中苯可除去挥发的溴,D中HBr使紫色石蕊变红,E中HBr与硝酸银反应生成淡黄色AgBr沉淀,F中NaOH可吸收尾气,倒扣的漏斗可防止倒吸,以此来解答。
(1)铁屑和溴发生反应:2Fe+3Br2=2FeBr3,生成的FeBr3作催化剂,使苯和液溴发生反应,化学方程式为![]()
(2)苯和液溴的反应是放热反应,且溴易挥发,挥发出来的溴蒸气对实验产生干扰,必须除去,可以利用溴易溶于有机物来除溴,因此试管C中苯的作用是除去HBr中混有的溴蒸气;HBr溶液显酸性,紫色石蕊溶液遇酸变红;AgNO3溶液与HBr发生反应:AgNO3+HBr=AgBr↓+HNO3,试管E中有淡黄色沉淀生成。
(3)纯净的溴苯为无色液体,因溶有溴而呈褐色,因此B中NaOH溶液的作用是除去溴苯中的溴,便于观察溴苯的颜色;溴苯是难溶于水、且密度比水的密度大的液体,故在溶液的底部可以观察到无色油状液体;
(4)在上述整套装置中,D、E中导管口均在液面上,F中有倒扣的漏斗刚好没入液面,则具有防倒吸的装置有D、E、F。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】锰及其化合物用途非常广泛,请回答下列问题:
(1)Mn3+在水溶液中容易歧化为MnO2和Mn2+ ,下列说法合理的是________
A.Mn3+的价电子构型为3d4,不属于较稳定的电子构型
B.根据Mn2+的电子构型可知,Mn4+中不含成对电子
C.Mn2+易被氧化,可能是因为Mn2+轨道内有大量自旋方向相同的电子
D.Mn2+与Fe3+具有相同的价电子构型,所以它们的化学性质相似
(2)锰的一种配合物的化学式为[ Mn( CO)5( CH3CN)]。配体CH3CN与中心原子形成配位键时,提供孤对电子的原子是_________原子(填写元素名称),该分子中碳原子的杂化方式为___________。
(3)研究发现,在成甲醇反应(CO2 +3H2=CH3OH +H2O)中,CO氧化物负载的Mn氧化物纳米粒子催化剂具有高活性。反应所涉及的4种物质中,沸点从高到低的顺序为___________,原因是________________,硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在______,NO![]() 的空间构型是______________(用文字描述)。
的空间构型是______________(用文字描述)。
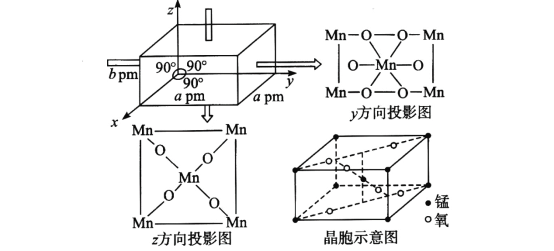
(4)某锰氧化物的晶胞结构如图所示,该锰氧化物的化学式为___________,该晶体中Mn的配位数是_______,该晶体中Mn之间的最近距离为_____cm(用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对二乙烯苯(![]() )可用作树脂、油漆及特种橡胶的原料下列说法正确的是
)可用作树脂、油漆及特种橡胶的原料下列说法正确的是
A.分子中所有原子可共平面B.一氯代物有4种(不考虑立体异构)
C.不能使酸性高锰酸钾溶液褪色D.1mol该分子最多可与2mol H2加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钠晶体[Na4Fe(CN)6·10H2O,M=484g·mol-1]可用作食盐抗结剂。请回答
(1)向Na4Fe(CN)6溶液中滴入FeCl3溶液,出现蓝色沉淀,其离子方程式为______________。
(2)已知:Ag4Fe(CN)6为白色难溶物, Cu2Fe(CN)6为红棕色难溶物。市售亚铁氰化钠常含有Cl-杂质,选用下列试剂设计实验方案进行Cl-检验。
试剂:稀HNO3、稀H2SO4、AgNO3溶液、CuSO4溶液、Na2CO3溶液、H2O2溶液
实验步骤 | 现象 |
①取少量样品,加入蒸馏水 | ②固体完全溶解得无色澄清溶液 |
③_______ | ④______ |
⑤静置,_____ | ⑥出现白色浑浊 |
(3)利用铈量法测定亚铁氰化钠晶体纯度的实验如下:称取1.2100g样品,置于500mL仪器a中,加入25mL除氧蒸馏水,加入25mL浓硫酸酸化并冷却,滴加3滴橘红色邻二氮菲(phen)—FeSO4指示剂,用0.1000mo1·L-1的Ce(SO4)2标准溶液滴定,发生反应:Ce4++[Fe(CN)6]4-=Ce3++[Fe(CN)6]3-。当溶液从橘红色变为淡黄色,即为终点。平行滴定3次,标准溶液的平均用量为24.50mL。
①仪器a的名称为_________________。
②“浓硫酸酸化”的实验操作为______________________
③样品纯度为__________________%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是优良的水处理剂,一种制备方法是将
是优良的水处理剂,一种制备方法是将![]() 、
、![]() 、
、![]() 混合共熔,反应为
混合共熔,反应为![]() ,下列关于该反应的说法不正确的是( )
,下列关于该反应的说法不正确的是( )
A.铁元素被氧化,氮元素被还原
B.![]() 是氧化产物,
是氧化产物,![]() 是还原产物
是还原产物
C.![]() 在酸性条件下不稳定,会迅速分解并生成氢气
在酸性条件下不稳定,会迅速分解并生成氢气
D.![]() 具有强氧化性,因而有杀菌作用
具有强氧化性,因而有杀菌作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在298K时,2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-197 kJ·mol-1,在相同的温度下,向密闭真空容器中通入2molSO2和1molO2,达到平衡时放出热量Q1; 向另一个同体积的密闭真空容器中通入1molSO2和0.5molO2,达到平衡时放出热量Q2,则下列关系中正确的是:( )
2SO3(g) ΔH=-197 kJ·mol-1,在相同的温度下,向密闭真空容器中通入2molSO2和1molO2,达到平衡时放出热量Q1; 向另一个同体积的密闭真空容器中通入1molSO2和0.5molO2,达到平衡时放出热量Q2,则下列关系中正确的是:( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
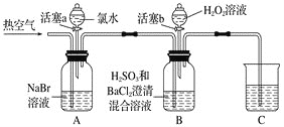
实验记录如下:
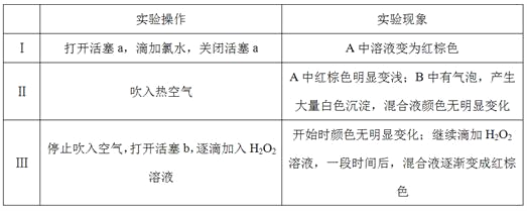
请回答下列问题:
(1)A中反应的离子方程式是__________________________________________________。
(2)实验操作Ⅱ吹入热空气的目的是_________________________________________。
(3)装置C的作用是____________,C中盛放的药品是_____________。
(4)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式_______________________。
(5)由上述实验得出的结论是_________________________________________________。
(6)实验反思:
①有同学认为实验操作Ⅱ吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是_____________________________________________________________________。
②实验操作Ⅲ,开始时颜色无明显变化的原因是(写出一条即可):____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像不符合反应Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH<0 的是(图中v是速率,φ为混合物中H2的体积百分含量)( )
FeO(s)+H2(g) ΔH<0 的是(图中v是速率,φ为混合物中H2的体积百分含量)( )
A. 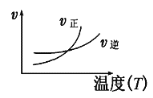 B.
B. 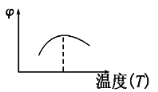
C.  D.
D. 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com