
����Ŀ����ΪԪ�����ڱ��е�һ���֣��г�10��Ԫ����Ԫ�����ڱ��е�λ�ã�����Ԫ�ط��š����ӷ��Ż�ѧʽ�ش��������⣮
��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 | |
2 | �� | �� | ||||||
3 | �� | �� | �� | �� | �� | �� | ||
4 | �� | �� |
��1���٢ۢ�����Ԫ������������Ӧˮ�����У�������ǿ���������ѧʽ��
��2��Ԫ�آߵ��⻯�ﳣ���º�Ԫ�آڵĵ��ʷ�Ӧ�Ļ�ѧ����ʽ��
��3���ٺ͢���Ԫ���γ��ĺ˻�����ĵ���ʽ �� �������к��еĻ�ѧ������Ϊ��
��4���ٵ�����������Ӧˮ����͢ݵ�������������Ӧ�����ӷ���ʽΪ ��
���𰸡�
��1��NaOH
��2��2K+2H2O=2KOH+H2��
��3��![]() �����Ӽ��빲�ۼ�����Ǽ��Լ���
�����Ӽ��빲�ۼ�����Ǽ��Լ���
��4��Al2O3+2OH��=2AlO2��+H2O
���������⣺����Ԫ�������ڱ��е�λ��֪���٢ڢۢܢݢޢߢ���ֱ���Na��K��Mg��Ca��Al��C��O��P��Cl��ArԪ�أ���1��ͬһ����Ԫ���У�Ԫ�صĽ���������ԭ�������������������Ԫ�صĽ�����Խǿ��������������ˮ����ļ���Խǿ�������⼸��Ԫ���н�������ǿ����NaԪ�أ�������������ˮ������NaOH���ʴ�Ϊ��NaOH����2������OԪ�أ����⻯����ˮ������KԪ�أ�ˮ�ͼط�Ӧ�����������غ���������ѧ��Ӧ����ʽΪ��2K+2H2O=2KOH+H2�����ʴ�Ϊ��H2O��2K+2H2O=2KOH+H2������3���ٺ͢���Ԫ���γ��ĺ˻�����ΪNa2O2 �� �����ʽΪ ![]() ���������������ӻ����������������������ӹ��ɣ��ƹ��������ӵ���ʽΪ
���������������ӻ����������������������ӹ��ɣ��ƹ��������ӵ���ʽΪ ![]() �����Թ������Ƶĵ���ʽΪ
�����Թ������Ƶĵ���ʽΪ ![]() �������Ӽ���O��O�Ǽ��Թ��ۼ����ʴ�Ϊ��
�������Ӽ���O��O�Ǽ��Թ��ۼ����ʴ�Ϊ�� ![]() �����Ӽ��빲�ۼ�����Ǽ��Լ�������4���ٵ�����������Ӧˮ����NaOH�͢ݵ����������Al2O3��Ӧ����ƫ�����ƺ�ˮ����Ӧ���ӷ���ʽΪAl2O3+2OH��=2AlO2��+H2O���ʴ�Ϊ��Al2O3+2OH��=2AlO2��+H2O�� ����Ԫ�������ڱ��е�λ��֪���٢ڢۢܢݢޢߢ���ֱ���Na��K��Mg��Ca��Al��C��O��P��Cl��ArԪ�أ���1��ͬһ����Ԫ���У�Ԫ�صĽ���������ԭ�������������������Ԫ�صĽ�����Խǿ��������������ˮ����ļ���Խǿ����2������OԪ�أ����⻯����ˮ������KԪ�أ�ˮ�ͼط�Ӧ�����������غ���������3���ٺ͢���Ԫ���γ��ĺ˻�����ΪNa2O2����������Ϊ���ӻ���������ӹ��ɣ���4���ٵ�����������Ӧˮ���NaOH���͢ݵ���������Al2O3����Ӧ����ƫ�����ƺ�ˮ��
�����Ӽ��빲�ۼ�����Ǽ��Լ�������4���ٵ�����������Ӧˮ����NaOH�͢ݵ����������Al2O3��Ӧ����ƫ�����ƺ�ˮ����Ӧ���ӷ���ʽΪAl2O3+2OH��=2AlO2��+H2O���ʴ�Ϊ��Al2O3+2OH��=2AlO2��+H2O�� ����Ԫ�������ڱ��е�λ��֪���٢ڢۢܢݢޢߢ���ֱ���Na��K��Mg��Ca��Al��C��O��P��Cl��ArԪ�أ���1��ͬһ����Ԫ���У�Ԫ�صĽ���������ԭ�������������������Ԫ�صĽ�����Խǿ��������������ˮ����ļ���Խǿ����2������OԪ�أ����⻯����ˮ������KԪ�أ�ˮ�ͼط�Ӧ�����������غ���������3���ٺ͢���Ԫ���γ��ĺ˻�����ΪNa2O2����������Ϊ���ӻ���������ӹ��ɣ���4���ٵ�����������Ӧˮ���NaOH���͢ݵ���������Al2O3����Ӧ����ƫ�����ƺ�ˮ��


 ��������ϵ�д�
��������ϵ�д� ��ӡ�Ļ���ʱ����ϵ�д�
��ӡ�Ļ���ʱ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Al2O3��H2O��Al2O3��3H3OΪ������������Fe2O3��SiO2 �� Ϊ��ȥɰ��������������������Ʒ�����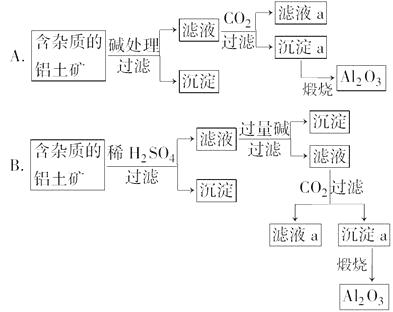
��1��������Ƶ����ַ����У��������ֿ��Ǿ���Ч����ǣ����ţ���
��2�����ᴿʱ�õ�ԭ�ϳ�������ˮ�⣬��������������������ѡ��Na2CO3 �� ��CaCO3 �� ��H2SO4 �� ��HCl����KOH����д���й���Ҫ��Ӧ�Ļ�ѧ����ʽ�������ӷ�Ӧ��Ҫд���ӷ���ʽ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ױ����������ʣ�Ϊ����ij��Ѫ�������������Ƿ���ʣ�����ò�Ѫ����ɵ���Һ�м��루 ��
A.AgNO3��Һ
B.�����ữ��BaCl2��Һ
C.KSCN��Һ
D.HNO3�ữ��Ba��NO3��2��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����п��ع㷺���ڸ��ֵ��������ĵ�Դ�����ij�ŵ���̿ɱ�ʾΪ��2Ag+Zn��OH��2![]() Ag2O+Zn+H2O�ش������й����⣮
Ag2O+Zn+H2O�ش������й����⣮
��1����صķŵ����������١��ڡ�����
��2���õ�������Ե�أ���ᡱ��������С�����
��3��д�����ʱ�����ĵ缫��Ӧʽ��
��4�����ʱ����ص�����Ӧ�ӵ�Դ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ��2NO2 ![]() 2NO+O2������̶����ܱ������У��ﵽƽ��״̬�ı�־�ǣ� �� �ٵ�λʱ��������n mol O2��ͬʱ����2n mol NO2
2NO+O2������̶����ܱ������У��ﵽƽ��״̬�ı�־�ǣ� �� �ٵ�λʱ��������n mol O2��ͬʱ����2n mol NO2
�ڵ�λʱ��������n mol O2��ͬʱ����2n mol NO
����NO2��NO��O2�����ʵ���Ũ�ȱ仯��ʾ�ķ�Ӧ���ʵı�Ϊ2��2��1��״̬
�ܻ���������ɫ���ٸı��״̬
�ݻ��������ܶȲ��ٸı��״̬
��������ѹǿ���ٸı��״̬
��������ƽ����Է����������ٸı��״̬��
A.�٢ܢޢ�
B.�ڢۢݢ�
C.�٢ۢܢ�
D.ȫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��Ϊ������Ԫ���γɵĵ��ʣ���Ԫ��A��Bͬ���ڣ�AԪ��ԭ�Ӱ뾶����BԪ��ԭ�Ӱ뾶����һ�������µ���A�͵���B������A��C�������ʵ���2��1��Ӧ���ֱ�����X��Y���ڲ�����B��C��Ԫ�سʸ��ۣ� �ֱ�ȡ3����ȫ��ͬ��������Ϊ1.52g�ɵ���A�͵���B��ɵĻ�����������ʵ�飺
���ڵ�һ����Ʒ�м���������ᣬ��ֽ�����ڱ�״���·ų�0.896L H2 �� ������������Ĺ���0.56g
���ڵڶ�����Ʒ�м������ŨNaOH��Һ���ȳ�ַ�Ӧ���ڱ�״���·ų�0.896L H2���������ڼ�Ĺ���0.96g
�۽���������Ʒ����������ǿ�����ɻ�����X����XͶ��ϡ�����У�X�ܽ��ҷų��ڿ���������ȼ������a L
�������������Ϣ��ʵ���¼�����������
��1��д������Ԫ�ص����ƣ�A����C����
��2���������B�����������ǣ�
��3�����㣺a= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������˵�����ж���ӦԪ�صĽ����ԡ��ǽ�����ǿ��������������( )
A. �ǽ�����̬�⻯����ȶ���
B. �ǽ����������Ӧˮ�������Ե�ǿ�����ʼ���û���Ӧ
C. ����������������ˮ���ᷴӦ�ľ��ҳ̶�
D. ����Na��Mg��Al�ֱ����������ᷴӦʱʧ���ӵ����׳̶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ�����ר�Һ�°�ĺ����ƼΪ�����Ƽҵ������ͻ�����ס�����NaCl��NH3��CO2��Ϊԭ���Ƶ�NaHCO3 �� ��������������йط�Ӧ�Ļ�ѧ����ʽΪ��
NH3��CO2��H2O=NH4HCO3
NH4HCO3��NaCl=NaHCO3����NH4Cl
2NaHCO3![]() Na2CO3��CO2����H2O��
Na2CO3��CO2����H2O��
��1��̼������뱥��ʳ��ˮ��Ӧ��������̼�����ƾ����ԭ����________(����ĸ���)��
A.̼������������ˮ
B.̼�����������ֽ�
C.̼�����Ƶ��ܽ����Խ�С����������Һ�����Ƚᾧ����
��2��ij̽���С����������Ƽ�ԭ��������̼�����Ƶ��Ʊ�ʵ�飬ͬѧ�ǰ�������Ƶķ���ʵ�顣
��һλͬѧ��������̼����ͨ�뺬���ı���ʳ��ˮ���Ʊ�̼�����ƣ�ʵ��װ������ͼ��ʾ(ͼ�мг֡��̶��õ�����δ����)��
�Իش������й����⣺
(��)��װ���е��Լ�����
(��)��װ����ϡ�������������
(��)ʵ����������NaHCO3����IJ�����(��������������)��
����һλͬѧ����ͼ����װ��(����װ��δ����)����ʵ�飺
(��)ʵ��ʱ�����ȴ���ͨ�����壬�ٴ���ͨ�����壻
(��)��ͬѧ��������װ�õ�b���¶����Ӽ�װ�ã�ԭ������
��3��������д��һ��ʵ������ȡ����̼�����Ƶķ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��X����ѧ��ѧ���������ʣ�����֮���ת����ϵ��ͼ��ʾ����Ӧ�����Ͳ��ֲ���ʡ�ԣ�����ش��������⣺ ![]()
��1����A��B��C��Ϊ��ɫ��Ӧ�ʻ�ɫ�Ļ����X��һ�ֳ������������壬��B��ˮ��Һ�еμ�2�η�̪����Һ��ɫ��A����B�Ļ�ѧ����ʽΪ ��
��2����B��һ�����Բ����B����C�����ӷ���ʽΪ ��
��3����A��һ��ʹʪ��ĺ�ɫʯ����ֽ���������壬Aת��ΪC�ǹ�ҵ�����е�һ����Ҫ��Ӧ���÷�Ӧ�Ļ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com