
| A、浓硫酸是强电解质,醋酸是弱电解质 |
| B、电解质都能导电,非电解质都不能导电 |
| C、酸性氧化物都是非金属氧化物,碱性氧化物都是金属氧化物 |
| D、氢氧化铁胶体电泳时阴极附近颜色加深 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡不移动 |
| B、混合气体的密度不变 |
| C、B的体积分数增大 |
| D、a mol/L<c(A)<2a mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
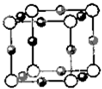 已知:A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满.请根据以上信息,回答下列问题:
已知:A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满.请根据以上信息,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al(OH)3、CaCO3都难溶,但溶解的部分都能完全电离 |
| B、复盐是纯净物,而混盐(如CaOCl2)是混合物 |
| C、弱电解质溶液中有溶质分子,但强电解质溶液中难以存在溶质分子 |
| D、电解质溶液能够导电,是因为通电使电解质电离产生了自由移动的离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
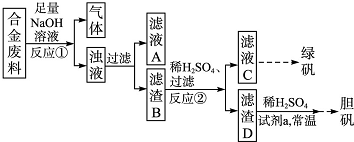
查看答案和解析>>
科目:高中化学 来源: 题型:
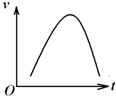 氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl-的速率v(纵坐标)与反应时间t(横坐标)的关系如图所示,已知该反应速率随着溶液中c(H+)的增大而加快.
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl-的速率v(纵坐标)与反应时间t(横坐标)的关系如图所示,已知该反应速率随着溶液中c(H+)的增大而加快.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com