
【题目】下列有关 HCl 和 HBr 的叙述错误的是( )
A.键能:HCl>HBrB.热稳定性:HBr>HCl
C.沸点:HBr>HClD.共用电子对偏移程度:HCl>HBr
科目:高中化学 来源: 题型:
【题目】相同温度下,甲、乙两个容积相等且不变的密闭容器中分别加入1molNH2COONH4 和2 molNH2COONH4, 均发生反应 NH2COONH4(s)![]() 2NH3(g)+CO2(g)。 当两容器中反应均达到平衡时, 下列说法不正确的是
2NH3(g)+CO2(g)。 当两容器中反应均达到平衡时, 下列说法不正确的是
A. NH2COONH4 的平衡转化率相等 B. NH3 的体积分数相等
C. 气体的平均相对分子质量相等 D. 平衡常数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2),黄绿色易溶于水的气体,是高效、低毒的消毒剂。回答下列问题:
(1)工业上可用KClO3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为_____.
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
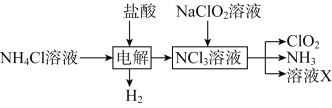
①电解时发生反应的化学方程式为_______________________________。
②除去ClO2中的NH3可选用的试剂是________(填标号)。
a.水 b.碱石灰
c.浓硫酸 d.饱和食盐水
(3)用下图装置可以测定混合气中ClO2的含量:
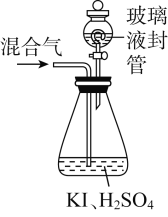
Ⅰ.在锥形瓶中加入足量的碘化钾,用50 mL水溶解后,再加入3 mL稀硫酸;
Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中;
Ⅴ.用0.100 0 mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-===2I-+S4O62-),指示剂显示终点时共用去20.00 mL硫代硫酸钠溶液。在此过程中:
①锥形瓶内ClO2与碘化钾反应的离子方程式为________________。
②测得混合气中ClO2的质量为__________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写不正确的是
A. 向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2===I2+2H2O
B. 碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO3-+Ba2++OH-===BaCO3↓+H2O
C. 向Al2(SO4)3溶液中加入过量的氨水:Al3++4NH3·H2O===AlO2-+4NH4++2H2O
D. 用铁棒作阴极,碳棒作阳极电解饱和氯化钠溶液:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a和b是组成物质种类最多的元素,c是地壳中含量最多的元素,d与b同族,e2+离子的3d轨道中有9个电子。回答下列问题:
(1)c、d两种元素形成的化合物统称硅石,可通过______________方法区分其结晶形和无定形的两种存在形态,c的电子排布图为_______________________。
(2)A和B是生活中两种常见的有机物,A能与CaCO3反应,可用于厨房除水垢;B分子中的碳原子数目与A中相同,可与钠反应放出气体。A中存在的化学键类型是______;
A.离子键 B.共价键 C.金属键 D.氢键
B分子中碳原子的轨道杂化类型是____。
(3)用“>”或“<”填空:
第一电离能 | 熔点 |
b___d | dc2晶体___d晶体 |
(4)c与e两种元素可形成一种半导体材料,化学式为e2c,在其立方晶胞内部有四个c原子,其余c原子位于面心和顶点,则该晶胞中有____个e原子,e元素位于元素周期表的_______区。
(5)向e2+硫酸盐的水溶液中加入过量的氨水,可得到深蓝色透明溶液,写出该配离子的化学式______________。
(6)e单质为面心立方晶体,其晶胞棱长为a nm,则e单质的密度为__________g·cm-3,其空间利用率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某医药中间体G的一种合成路线如下:

已知:(1)A的核磁共振氢谱有两组峰,且峰面积之比为3∶1;
(2)G的结构简式为:![]() ;
;
(3)![]() 。
。
回答下列问题:
(1)A的名称是_____________;B→C的反应类型是_____________。
(2)G的分子式为___________;G中官能团名称是_____________;1 mol G与NaOH溶液反应最多消耗______ mol NaOH。
(3)H的结构简式为_____________。
(4)D在浓硫酸加热的条件下会生成一种含六元环的化合物,写出该反应的化学方程式_________________________________。
(5)I与F互为同分异构体,则满足下列条件的I的结构有______种(不包括F)。
①苯环上有两个取代基;②遇FeCl3溶液显紫色;③能与NaOH反应。
(6)根据题中所给信息,写出由苯酚,甲苯为原料制备苯甲酸苯酚酯的合成路线(其它无机试剂任选):_________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液。回答下列问题:
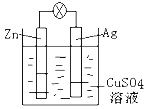
①Zn电极是_______(填“正极”或“负极”),反应中质量会变______(填“大”,“小”或“不变”)
②银电极上发生_____反应(“氧化”或“还原”),电极反应式为__________。
(2)甲醇(CH3OH)是一种重要的化工原料,在生产中有着重要的应用。甲醇燃料电池能量转化率高,对环境无污染。该燃料电池的工作原理如图所示:(质子交换膜可以通过H+)
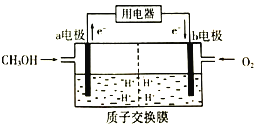
通入甲醇气体的电极为电池的_____(填“正”或“负")极,电解质溶液中H+向_____电极移动(填“a"或“b")。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2C12)和氯化亚砜(SOC12)在空气中遇水蒸气发生剧烈反应,并产生大量白雾。硫酰氯(SO2C12)常用作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。合成的反应式为: SO2(g) + Cl2(g)![]() SO2Cl2(l) △H=-197.3 kJ·mol-1
SO2Cl2(l) △H=-197.3 kJ·mol-1
物质 | 熔点/℃ | 沸点/℃ | 其他性质 |
SO2C12 | -54.1 | 69.1 | 易分解:SO2C12 |
合成SO2C12的装置如下图所示(夹持仪器已省略),请回答有关问题:
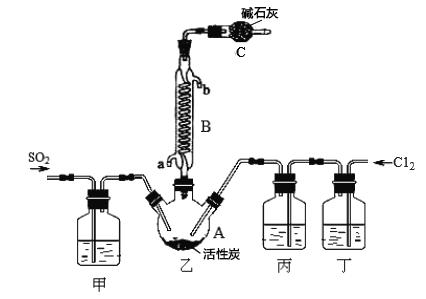
(1)从下表中选择相应的装置完成填空:
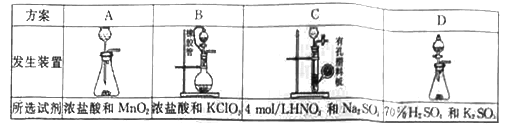
①制备SO2选________(填字母)。
②写出用所选装置制取Cl2的离子方程式_________________。
(2)合成SO2C12的装置图中仪器B的名称为_________________;丁中盛放的是_____________。
(3)反应结束后,将乙中混合物分离开的实验操作名称是 _______________。
(4)图中装置C的作用是__________________。
(5)为提高本实验中的产率,在实验操作中还需要注意的事项有(只答—条即可)__________。
(6)氯化亚砜(SOCl2)与水反应的化学方程式为_____,蒸干A1C13溶液不能得到无水AlCl3,用SOC12与AlCl3 6H2O的混合加热,可得到无水A1C13,试解释原因__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com