
【题目】周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a和b是组成物质种类最多的元素,c是地壳中含量最多的元素,d与b同族,e2+离子的3d轨道中有9个电子。回答下列问题:
(1)c、d两种元素形成的化合物统称硅石,可通过______________方法区分其结晶形和无定形的两种存在形态,c的电子排布图为_______________________。
(2)A和B是生活中两种常见的有机物,A能与CaCO3反应,可用于厨房除水垢;B分子中的碳原子数目与A中相同,可与钠反应放出气体。A中存在的化学键类型是______;
A.离子键 B.共价键 C.金属键 D.氢键
B分子中碳原子的轨道杂化类型是____。
(3)用“>”或“<”填空:
第一电离能 | 熔点 |
b___d | dc2晶体___d晶体 |
(4)c与e两种元素可形成一种半导体材料,化学式为e2c,在其立方晶胞内部有四个c原子,其余c原子位于面心和顶点,则该晶胞中有____个e原子,e元素位于元素周期表的_______区。
(5)向e2+硫酸盐的水溶液中加入过量的氨水,可得到深蓝色透明溶液,写出该配离子的化学式______________。
(6)e单质为面心立方晶体,其晶胞棱长为a nm,则e单质的密度为__________g·cm-3,其空间利用率为________。
【答案】X-射线衍射实验 ![]() B sp3 > > 16 ds [Cu(NH3)4]2+
B sp3 > > 16 ds [Cu(NH3)4]2+ ![]() 74%
74%
【解析】
a和b是组成物质种类最多的元素,即a是H元素,b是C元素,因为有机物的种类最多,c是地壳中含量最多的元素即O元素,d与b同族,即d是Si元素,e2+离子的3d轨道中有9个电子,即d的核外电子排布为:[Ar]3s23p63d104s1,所以d元素是Cu元素。
(1) c、d分别是O和Si元素,他们形成的硅石,可通过X-射线衍射实验方法区分其结晶形和无定形的两种存在形态,O原子的电子排布图为![]() ;
;
故答案为:X-射线衍射实验,![]() ;
;
(2) A能与CaCO3反应,可用于厨房除水垢,即A是乙酸,B分子中的碳原子数目与A中相同,可与钠反应放出气体,即B是乙醇,乙酸中存在的化学键类型是共价键;乙醇分子中的C原子的杂化类型是sp3杂化;
故答案为:B;sp3;
(3)b是碳元素,d是硅元素,同一主族元素从上到下,第一电离能逐渐减小,所以第一电离能:C>Si,SiO2中存在Si—O共价键,Si晶体中存在Si—Si共价键,其中Si—O共价键键长比Si—Si共价键键长短,键长越短,键能越大,熔点就越高,所以SiO2晶体的熔点高于Si晶体;
故答案为:> ,>;
(4) 在其立方晶胞内部有四个c原子,其余c原子位于面心和顶点,即每个晶胞中含有8×![]() +6×
+6×![]() +4=8个O原子,根据化学式Cu2O,可知,该晶胞中含有16个Cu原子,Cu元素是29号元素,即位于元素周期表中的ds区;
+4=8个O原子,根据化学式Cu2O,可知,该晶胞中含有16个Cu原子,Cu元素是29号元素,即位于元素周期表中的ds区;
故答案为:16 ,ds;
(5) 向e2+硫酸盐的水溶液中加入过量的氨水,即得到蓝色的Cu(NH3)4SO4,该配离子的化学式为:[Cu(NH3)4]2+;
故答案为:[Cu(NH3)4]2+;
(6) e即Cu单质为面心立方晶体,即原子位于顶点和面心,所以这个晶胞中含有Cu原子8×![]() +6×
+6×![]() =4个,晶胞边长anm=a×10-7cm,晶胞体积=(a×10-7cm)3,密度=
=4个,晶胞边长anm=a×10-7cm,晶胞体积=(a×10-7cm)3,密度=![]() =
=![]() =
=![]() g·cm-3;它的空间利用率为:
g·cm-3;它的空间利用率为: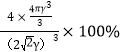 =74%;
=74%;
故答案为:![]() , 74%。
, 74%。


科目:高中化学 来源: 题型:
【题目】H3BO3可以通过电解NaB(OH)4溶液的方法制备,其工作原理如图,下列叙述错误的是( )

A. M室发生的电极反应式为:2H2O-4e- = O2↑+4H+
B. N室中:a% <b%
C. b膜为阴膜,产品室发生反应的化学原理为强酸制弱酸
D. 理论上每生成1mol产品,阴极室可生成标准状况下5.6L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,在20.0mL0.10mol·L-1氯水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。己知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是

A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0mL
C. M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N点处的溶液中pH<12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】秦皮是一种常用的中药,具有抗炎镇痛、抗肿瘤等作用。“秦皮素”是其含有的一种有效成分,结构简式如下图所示,有关其性质叙述不正确的是
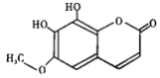
A. 1mol 该化合物最多能与3 mol NaOH 反应 B. 该有机物分子式为C10H8O5
C. 该有机物能发生加成、氧化、取代等反应 D. 分子中有四种官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于能源、能量转化及其说法正确的是( )
A.化石能源是可再生能源
B.太阳能不是清洁能源
C.能量在转化或转移的过程中总量保持不变
D.核能只能通过重核裂变获取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关 HCl 和 HBr 的叙述错误的是( )
A.键能:HCl>HBrB.热稳定性:HBr>HCl
C.沸点:HBr>HClD.共用电子对偏移程度:HCl>HBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化钛是生产金属钛及其化合物的重要中间体。某校化学课外活动小组准备利用下图装置制备四氯化钛(部分夹持仪器已略去)。
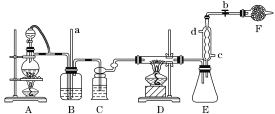
资料表明:室温下,四氯化钛为无色液体,熔点:-25 ℃,沸点:136.4 ℃。在空气中发烟生成二氧化钛固体。在650~850 ℃下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和一种有毒气体。回答下列问题:
(1)实验时在仪器中加试剂前要先___________________________。
(2)实验中分液漏斗上口玻璃塞连接导管的作用是__________________________________ B装置的作用是_____________________________。
(3)写出D装置中物质制备的化学方程式________________________________;写出四氯化钛在空气中发烟的化学方程式______________________________。
(4)E装置作用是_______________________。
(5)F装置中盛装的物质是________。
(6)该实验设计略有缺陷,请指出其不足之处:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,参照元素①~⑨在表中的位置,按要求回答下列问题:
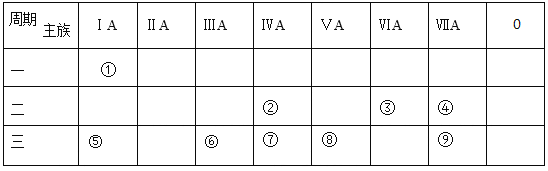
(1)在元素①~⑨,最活泼的金属元素是______(填元素名称);最活泼的非金属元素名称是______(填元素名称)
(2)用电子式表示元素③与⑤形成的原子个数比为1∶2的化合物 ______。元素①和③所形成的化学键的类型是_______。
(3)②、⑤、⑦三种元素的原子半径由大到小的顺序是______(用元素符号表示)。
(4)元素④和⑨所能形成的气态氢化物的稳定性______(用化学式表示);元素⑦、⑧、⑨的最高价氧化物对应的水化物的酸性由强到弱的顺序______(用化学式表示);
(5)写出元素![]() 和
和![]() 的最高价氧化物的水化物相互反应的离子方程式:______。
的最高价氧化物的水化物相互反应的离子方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,可用废镍催化剂(主要含Ni、Al,少量Cr、FeS 等)来制备,其工艺流程如下:

回答下列问题:
(1)“浸泡除铝”时,发生反应的离子反应方程式为_________________________;
(2)“溶解”时放出的气体为_______________ (填化学式);
(3)已知该条件下金属离子开始沉淀和完全沉淀的pH如下表:
开始沉淀的pH | 完全沉淀的pH | |
Ni2+ | 6.2 | 8.6 |
Fe2+ | 7.6 | 9.1 |
Fe3+ | 2.3 | 3.3 |
Cr3+ | 4.5 | 5.6 |
“调pH 1”时,溶液pH范围为______________________;
(4)在空气中加热Ni(OH)2可得NiOOH,请写出此反应的化学方程式_____________;

(5)金属铬在溶液中有多种存在形式, CrO42—和Cr2O72—在溶液中可相互转化。室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72—)随c(H+)的变化如图所示,用离子方程式表示Na2CrO4溶液中的转化反应________________,根据A点数据计算出该转化反应的平衡常数为______________,温度升高,溶液中CrO42—的平衡转化率减小,则该反应的△H____0(填“>”、“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com