
【题目】NaClO2常用来漂白织物,其漂白能力是漂白粉的4~5倍NaClO2也是一种重要的杀菌消毒剂。工业上生产NaClO2的一种工艺流程如下图所示:

(1)ClO2发生器中的产品之一是NaHSO4,在该发生器中所发生反应的离子方程式为___________。
(2)反应结束后,向ClO2发生器中通入一定量空气,目的是___________。
(3)吸收器中发生反应的化学方程式为___________。吸收器中要用冷的NaOH溶液和H2O2溶液吸收CO2,原因是___________。
(4)将ClO2通入食盐水中,用情性电极电解,也可以制得NaClO2产品。阳极的电解产物是___________(填化学式),阴极的电极反应式为___________。
(5)相同条件下,1 mol NaClO2与___________gCl2的氧化能力相当。
【答案】2C103-+S02=2C102+SO42- 将C102赶入吸收器,确保其被充分吸收 2Cl02+2Na0H+H202=2NaClO2+02+2H20 温度过高,H2O2分解增多,Cl02逸出加快,不利于Cl02的吸收 Cl2 C102+e-=C102- 142
【解析】
(1)ClO2和S02、H2SO4反应生成C102和NaHS04,化学方程式为:2NaC103+ S02+ H2SO4=2Cl02+ 2NaHS04。
(2)反应结束后,发生器中仍有少量C102,用空气可以将其排出,确保其被充分吸收。
(3)吸收器中双氧水与Cl02在碱性条件下发生氧化还原反应生成NaClO2。
(4)阳极:2Cl—-2e-= Cl2,阴极:C102+e-=C102-。
(5)NaClO2~Cl-~4e-,Cl2~2Cl-~2e-,依据电子转移数目相等,相同条件下,1 mol NaClO2与2molCl2的氧化能力相当,从而得出氯气的质量。
(1)ClO2和S02、H2SO4反应生成C102和NaHS04,化学方程式为:2NaC103+ S02+ H2SO4=2Cl02+ 2NaHS04,反应的离子方程式为2C103-+S02=2C102+SO42-,故答案为:2C103-+S02=2C102+SO42-。
(2)反应结束后,发生器中仍有少量C102,用空气可以将其排出,确保其被充分吸收,故答案为:将C102赶入吸收器,确保其被充分吸收。
(3)吸收器中双氧水与Cl02在碱性条件下发生氧化还原反应生成NaClO2,反应的化学方程式为:2Cl02+2Na0H+H202=2NaClO2+02+2H20,为了提高Cl02的利用率及防止H2O2分解,反应温度不能过高,故答案为:2Cl02+2Na0H+H202=2NaClO2+02+2H20;温度过高,H2O2分解增多,Cl02逸出加快,不利于Cl02的吸收。
(4)阳极:2Cl—-2e-= Cl2,阳极的电解产物是Cl2,阴极:C102+e-=C102-,故答案为:Cl2;C102+e-=C102-。
(5)NaClO2~Cl-~4e-,Cl2~2Cl-~2e-,依据电子转移数目相等,相同条件下,1 mol NaClO2与2molCl2的氧化能力相当,所以氯气的质量为142g,故答案为:142。


科目:高中化学 来源: 题型:
【题目】常温下,在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液的pH=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是
A. 1∶9 B. 1∶1 C. 1∶2 D. 1∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度中,将1 molA 和2mol B放入容积为5L 的某密闭容器中发生反应:A(s) +2B(g)![]() C(g)+2D(g)。5min后达到平衡,测得容器内B的浓度减少了0.2mol/L,则下列叙述不正确的是
C(g)+2D(g)。5min后达到平衡,测得容器内B的浓度减少了0.2mol/L,则下列叙述不正确的是
A. 在5min 内该反应用C 的浓度变化表示的反应速率为0.02mol/(L·min)
B. 平衡时B 的转化率为50%
C. 平衡时B 的体积分数约为33.3%
D. 初始时的压强与平衡时的压强比为4 :5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】比较填空(填“>”、“<”或“=”)
(1)Ⅰ.比较等体积等浓度的溶液①盐酸 ②醋酸 与足量锌粒反应产生氢气的体积,① ②
Ⅱ.比较2H2(g)+O2(g)![]() 2H2O(g) ΔH 1 2H2(g)+O2(g)
2H2O(g) ΔH 1 2H2(g)+O2(g)![]() 2H2O(l) ΔH2的反应热 ΔH1 ΔH2
2H2O(l) ΔH2的反应热 ΔH1 ΔH2
Ⅲ.比较常温下两溶液水的电离程度,①pH=4盐酸 ②pH =10氨水溶液① ②
Ⅳ.同温度下溶液①使甲基橙呈现红色,溶液②使石蕊呈现紫色,比较两者pH① ②
(2)Ⅴ.已知某可逆反应aA(g) + bB(g) ![]() cC(g) + dD(g)。反应过程中,当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如右图,则a + b c + d
cC(g) + dD(g)。反应过程中,当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如右图,则a + b c + d

Ⅵ.比较①0.1mol/L醋酸与②0.01mol/L醋酸的导电能力,① ②
Ⅶ.1mol/L氨水与0.1mol/L氨水的c(OH-)之比 10
Ⅷ.体积相同的恒容密闭容器,在A中充入SO2和O2各1g,在B中充入SO2和O2各2g,相同条件下发生反应2SO2+O2![]() 2SO3 平衡时 SO2的转化率A B
2SO3 平衡时 SO2的转化率A B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:在300 K时,A(g)+B(g) ![]() 2C(g)+D(s)的化学平衡常数K=4,在该温度下,向1 L容器中加入1 mol A和1 mol B发生反应,下列叙述不能作为该反应达到平衡状态的标志的是
2C(g)+D(s)的化学平衡常数K=4,在该温度下,向1 L容器中加入1 mol A和1 mol B发生反应,下列叙述不能作为该反应达到平衡状态的标志的是
①C的生成速率与C的消耗速率相等 ②单位时间内生成a mol A,同时消耗2a mol C ③A、B、C的浓度不再变化 ④C的物质的量不再变化 ⑤混合气体的总压强不再变化 ⑥混合气体的密度不再变化 ⑦A、B、C的分子数之比为1∶1∶2
A. ②⑤ B. ④⑦ C. ②③ D. ④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2+ B2= 2AB的能量变化如图所示,则下列说法正确的是( )

A. 该反应是吸热反应
B. 断裂1 mol A—A键和1 mol B—B键能放出x kJ的能量
C. 断裂2 mol A—B键需要吸收y kJ的能量
D. 2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是一种有机光电材料中间体,由A制备F的一种合成路线如下:

已知:![]()
回答下列问题:
(1)A的结构简式为________,C的化学名称是______。
(2)①、③的反应类型分别是______、_______。
(3)②的反应条件是_______,有机物X的结构简式为____________。
(4)反应⑤的化学方程式为___________________。
(5)芳香化合物H是D的同分异构体,满足下列条件的同分异构体共有____种;
a.能发生银镜反应 b.含有—C≡CH结构 c.无—C≡C—O—结构
写出其中核磁共振氢谱峰面积比为1:2:2:1的一种有机物的结构简式_______。
(6)写出由1-丁炔和乙炔为原料制取化合物 的合成略线(其他试剂任选)_____。
的合成略线(其他试剂任选)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,当下列物理量不再改变时,表明反应:A(s)+2B(g) ![]() C(g)+D(g) 已达平衡标志的是
C(g)+D(g) 已达平衡标志的是
A. 混合气体的压强 B. 混合气体的密度
C. B物质的分子量 D. 气体的总物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分:
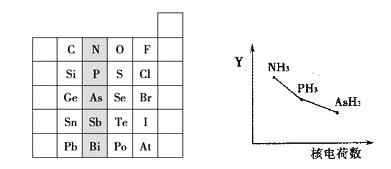
⑴ 阴影部分元素的外围电子排布式的通式为_________。Sb的元素名称为________。基态P原子中,电子占据的最高能级符号为______,该能层具有的原子轨道数为______。
⑵ 氮族元素氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如上右图所示,则Y轴可表示的氢化物(RH3)性质可能有________。
A.稳定性B.沸点C.R—H键能D.分子间作用力
⑶ 某种新型储氧材料的理论结构模型如下左图所示,图中虚线框内碳原子的杂化轨道类型有____________种。

⑷ CN-和Fe2+、Fe3+及K+能形成一种蓝色配位化合物普鲁士蓝。上右图是该物质的的结构单元(K+未标出),该图是普鲁士蓝的晶胞吗?_______ (填“是”或“不是”),平均每个晶胞中含有______个K+。

⑸磷酸盐与硅酸盐之间具有几何形态的相似性。如多磷酸盐与多硅酸盐一样,也是通过四面体单元通过共用顶角氧离子形成岛状、链状、层状、骨架网状等结构型式。不同的是多硅酸盐中是{SiO4}四面体,多磷酸盐中是{PO4}四面体。右图为一种无限长单链结构的多磷酸根,该多磷酸根的化学式为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com