
【题目】ClO2是新一代饮用水的消毒剂,许多发达国家的自来水厂采用ClO2代替Cl2来进行自来水消毒.我国最近成功研制出制取ClO2的新方法,其反应的微观过程如下所示: 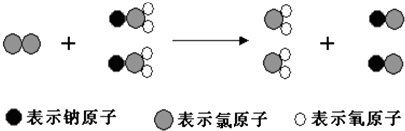
下列有关该反应的叙述中正确的是( )
A.该反应的化学方程式为Cl2+2NaClO2═2ClO2+2NaCl
B.该反应是应是复分解反应
C.反应中Cl2既是氧化剂,又是还原剂
D.NaClO2和ClO2中Cl元素的化合价相同
【答案】A
【解析】解:A.由三种小球表示的原子及微观过程可知,反应物为氯气和NaClO2 , 生成物为ClO2和NaCl,则反应为Cl2+2NaClO2═2ClO2+2NaCl,故A正确;B.由不同的小球代表的原子可知,反应物为氯气和NaClO2 , 氯气为单质,则该反应一定不是复分解反应,故B错误;
C.Cl2+2NaClO2═2ClO2+2NaCl,反应中氯气中 的氯元素化合价0价变化为﹣1价,NaClO2中氯元素化合价+3价升高到+4价,所以氯气做氧化剂,故C错误;
D.根据化合价规则,NaClO2和ClO2中Cl的化合价分别是+3价和+4价,化合价不一样,故D错误;
故选A.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下向10mL 0.1molL﹣1CH3COONa溶液中,不断通入HCl后,CH3COO﹣与CH3COOH浓度的变化趋势如图所示(不考虑溶液体积变化),下列说法不正确的是( ) 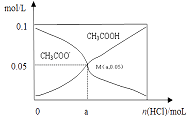
A.M点溶液中水的电离程度比原溶液小
B.在M点时,c(H+)﹣c(OH﹣)=(100a﹣5.0×10﹣2) mol/L
C.随着HCl的通入, ![]() 值不断减小
值不断减小
D.当n(HCl)=1.0×10﹣3mol时,溶液中c(Na+)>c(Cl﹣)>c(CHCOO﹣)>c(H+)>c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一瓶无色澄清溶液,其中可能含有Na+、Mg2+、Ba2+、Cl﹣、SO ![]() 、CO
、CO ![]() 离子.现进行以下实验: ①用pH试纸检验溶液,发现溶液呈强酸性;
离子.现进行以下实验: ①用pH试纸检验溶液,发现溶液呈强酸性;
②取部分溶液逐滴加入NaOH溶液,使溶液由酸性变成碱性,无沉淀产生;
③取少量②中的碱性溶液,滴加Na2CO3溶液,有白色沉淀产生.
(1)根据上述事实确定:该溶液中肯定存在的离子有;肯定不存在的离子有;可能存在的离子有 .
(2)写出③中发生反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,还原剂与氧化剂的质量比和物质的量之比不相同的是( )
A.常温下用NaOH溶液吸收Cl2
B.Na在空气中燃烧
C.Na2O2吸收CO2
D.S在空气中燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某常见元素M的单质及其化合物间的转化关系图,其中X,Y,Z,W四种物质中均含有元素M,E是另一种单质,下列有关说法中不正确的是( ) ![]()
A.W可能是硫酸
B.Y不可能是Mg
C.X可能是钠
D.Z可能是CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷与氧气可发生如下反应:P4+5O2===P4O10。已知断裂下列化学键需要吸收的能量分别为P-P:a kJ·mol-1、P—O:b kJ·mol-1、P===O:c kJ·mol-1、O===O:d kJ·mol-1。根据下图所示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )

A. (6a+5d-4c-12b) kJ·mol-1
B. (4c+12b-6a-5d) kJ·mol-1
C. (4c+12b-4a-5d) kJ·mol-1
D. (4a+5d-4c-12b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Na2O2和NaHCO3的混合物粉末分为两等份,其中一份加入100mL盐酸,充分反应后溶液为中性,放出气体(已干燥)2.24L(标准状况),将生成的气体全部通入另一份混合粉末,充分反应后气体的体积变为2.016L(标准状况),问:
(1)写出有关反应的方程式,是离子反应的写离子方程式:;;;
(2)2.24L气体的成分为:;
(3)试通过讨论并计算每份混合粉末中Na2O2和NaHCO3的物质的量:第一种情况:n(Na2O2)=mol和n(NaHCO3)=mol;
第二种情况:n(Na2O2)=mol和n(NaHCO3)=mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式表达正确的是(![]() 的绝对值均正确)
的绝对值均正确)
A. C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g) △H=–1367.0 kJ/mol(燃烧热)
B. NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) △H= +57.3kJ/mol(中和热)
C. S(s)+O2(g)=SO2(g) △H=–269.8kJ/mol (反应热)
D. 2NO2=O2+2NO △H= +116.2kJ/mol (反应热)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,某平衡体系中含有X、Y、Z、W四种物质,此温度下发生反应的平衡常数表达式为K= ![]() .有关该平衡体系的说法正确的是( )
.有关该平衡体系的说法正确的是( )
A.当混合气体的平均相对分子质量保持不变时,反应达平衡
B.增大压强,各物质的浓度不变
C.升高温度,平衡常数K增大
D.增加X的量,平衡既可能正向移动,也可能逆向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com