
【题目】下列反应中,还原剂与氧化剂的质量比和物质的量之比不相同的是( )
A.常温下用NaOH溶液吸收Cl2
B.Na在空气中燃烧
C.Na2O2吸收CO2
D.S在空气中燃烧
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】区别CH4、CH2=CH2、CH≡CH的最简易方法是( )
A.分别通入溴水
B.分别通入酸性高锰酸钾溶液
C.分别在空气中点燃
D.分别通入盛有碱石灰的干燥管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列除杂的离子方程式,括号内的物质为杂质.
物质(杂质) | 离子方程式 |
FeCl2 (FeCl3) | (1) |
CO2 (HCl) | (2) |
NaHC03 溶液(Na2C03) | (3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:
2CH3CH2CH2CH2OH ![]() (CH3CH2CH2CH2)2O+H2O
(CH3CH2CH2CH2)2O+H2O
反应物和产物的相关数据如下
相对分子质量 | 沸点/℃ | 密度/(gcm﹣3) | 水中溶解性 | |
正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
合成反应:
①将6mL浓硫酸和37g正丁醇,按一定顺序添加到A中,并加几粒沸石.
②加热A中反应液,迅速升温至135℃,维持反应一段时间.分离提纯.
③待A中液体冷却后将其缓慢倒人盛有70mL水的分液谝斗中,振摇后静置,分液得粗产物.
④粗产物依次用40mL水、20mL NaOH溶液和40mL水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙.
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11g.
请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为 .
(2)加热A前,需先从 (填“a”或“b”)口向B中通入水.
(3)步骤③的目的是初步洗去 , 振摇后静置,粗产物应从分液漏斗的(填“上”或“下”)口分离出.
(4)步骤③巾最后一次水洗的目的为 .
(5)步骤⑤中,加热蒸馏时应收集(填选项字母)左右的馏分.a.100℃b.117℃c. 135℃d.142℃
(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A.分水器中上层液体的主要成分为 , 下层液体的主要成分为 .
(7)本实验中,正丁醚的产率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Mg2C3的结构与CaC2相似,由此可断定Mg2C3与水反应的产物是( )
A.Mg(OH)2和CH≡CH
B.MgO和CH≡CH
C.Mg(OH)2和CH3CH=CH2
D.Mg(OH)2和CH3C≡CH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在1L的密闭容器中充入NO2发生如下反应:2NO2(g)N2O4(g);△H=﹣57kJmol﹣1
(1)该反应的△S0(填“>”、“<”或“=”).
(2)当开始充入0.03mol的NO2时,25℃时,实验测得NO2的平衡浓度为0.01molL﹣1 , 则NO2的平衡转化率(α)是 . 25℃时上述反应的平衡常数K= .
(3)25℃时,实验测得该反应的活化能Ea=92.4kJmol﹣1 . 下列能量关系图合理的是 . 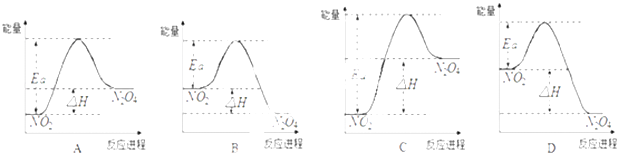
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是新一代饮用水的消毒剂,许多发达国家的自来水厂采用ClO2代替Cl2来进行自来水消毒.我国最近成功研制出制取ClO2的新方法,其反应的微观过程如下所示: 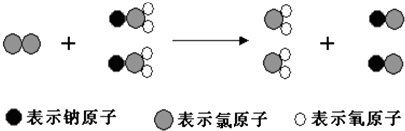
下列有关该反应的叙述中正确的是( )
A.该反应的化学方程式为Cl2+2NaClO2═2ClO2+2NaCl
B.该反应是应是复分解反应
C.反应中Cl2既是氧化剂,又是还原剂
D.NaClO2和ClO2中Cl元素的化合价相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
阳离子 | K+、Na+ 、Cu2+、 Al3+ |
阴离子 | SO |
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,仅有B为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸酸化的硝酸钡溶液,只有A中放出无色气体,只有D中产生白色沉淀;
⑤将B、C两溶液混合,未见沉淀或气体生成.根据上述实验填空:
(1)写出B、D的化学式:B , D .
(2)C可用作净水剂,用离子方程式表示其净水原理 .
(3)将含0.01mol A的溶液与含0.02mol E的溶液反应后,向溶液中滴加0.1molL﹣1稀盐酸.下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是
(4)在mmL b molL﹣1 C溶液中,加入等体积a molL﹣1 的E溶液.当a≤3b时,生成沉淀的物质的量是 mol;当3b<a<4b件时,生成沉淀的物质的量是 mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.稀硫酸与氢氧化钡溶液反应:H++OH﹣═H2O
B.碳酸氢钠溶液与盐酸反应:CO ![]() +2H+═CO2↑+H2O
+2H+═CO2↑+H2O
C.铝与氢氧化钠溶液反应:2Al+2OH﹣+2H2O═2AlO ![]() +3H2↑
+3H2↑
D.铁与氯化铁溶液反应:Fe3+Fe═2Fe2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com