
【题目】下列离子方程式书写正确的是( )
A.稀硫酸与氢氧化钡溶液反应:H++OH﹣═H2O
B.碳酸氢钠溶液与盐酸反应:CO ![]() +2H+═CO2↑+H2O
+2H+═CO2↑+H2O
C.铝与氢氧化钠溶液反应:2Al+2OH﹣+2H2O═2AlO ![]() +3H2↑
+3H2↑
D.铁与氯化铁溶液反应:Fe3+Fe═2Fe2+
科目:高中化学 来源: 题型:
【题目】下列反应中,还原剂与氧化剂的质量比和物质的量之比不相同的是( )
A.常温下用NaOH溶液吸收Cl2
B.Na在空气中燃烧
C.Na2O2吸收CO2
D.S在空气中燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式表达正确的是(![]() 的绝对值均正确)
的绝对值均正确)
A. C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g) △H=–1367.0 kJ/mol(燃烧热)
B. NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) △H= +57.3kJ/mol(中和热)
C. S(s)+O2(g)=SO2(g) △H=–269.8kJ/mol (反应热)
D. 2NO2=O2+2NO △H= +116.2kJ/mol (反应热)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,在350℃时会迅速分解生成CaO和O2 , 杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面,其工业生产流程如下:
(1)步骤②制取CaO28H2O的反应(填“属于”或“不属于”)氧化还原反应.
(2)该流程中可循环使用的物质是 .
(3)检验CaO28H2O是否洗净的方法是 .
(4)在CaO28H2O加热脱水的过程中,需不断通入不含二氧化碳的氧气,目的是抑制CaO2分解和 .
(5)实验室用如图所示装置测定产品中CaO2的含量(加热、夹持、连接管等仪器省略).
①装置连接的顺序为(填字母);A中药品为 .
②写出实验开始前检验装置的气密性的方法: .
③若所取产品的质量是m g,测得气体体积为V mL(已换算成标准状况),则产品中CaO2的质量分数为(用含m、V的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来对CO2的有效控制及其高效利用的研究正引起全球广泛关注.由CO2制备甲醇过程可能涉及反应如下:
反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H1=﹣49.58kJmol﹣1
反应Ⅱ:CO2(g)+H2(g)CO (g)+H2O(g)△H2
反应Ⅲ:CO(g)+2H2(g)CH3OH(g)△H3=﹣90.77kJmol﹣1
回答下列问题:
(1)反应Ⅱ的△H2= , 反应Ⅲ自发进行条件是(填“较低温”、“较高温”或“任何温度”).
(2)在一定条件下2L恒容密闭容器中充入一定量的H2和CO2仅发生反应Ⅰ,实验测得在不同反应物起始投入量下,反应体系中CO2的平衡转化率与温度的关系曲线,如图1所示.
①据图可知,若要使CO2的平衡转化率大于40%,以下条件中最合适的是
A.n(H2)=3mol,n(CO2)=1.5mol; 650KB.n(H2)=3mol,n(CO2)=1.7mol;550K
C.n(H2)=3mol,n(CO2)=1.9mol; 650KD.n(H2)=3mol,n(CO2)=2.5mol;550K
②在温度为500K的条件下,充入3mol H2和1.5mol CO2 , 该反应10min时达到平衡:
a.用H2表示该反应的速率为;
b.该温度下,反应I的平衡常数K=;
c.在此条件下,系统中CH3OH的浓度随反应时间的变化趋势如图所示,当反应时间达到3min时,迅速将体系温度升至600K,请在图2中画出3~10min内容器中CH3OH浓度的变化趋势曲线:
(3)某研究小组将一定量的H2和CO2充入恒容密闭容器中并加入合适的催化剂(发生反应I、Ⅱ、Ⅲ),测得在不同温度下体系达到平衡时CO2的转化率(a)及CH3OH的产率(b),如图3所示,请回答问题:
①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是(选填编号).
A.改用高效催化剂 B.升高温度C.缩小容器体积 D.分离出甲醇 E.增加CO2的浓度
②据图可知当温度高于260℃后,CO的浓度随着温度的升高而(填“增大”、“减小”、“不变”或“无法判断”),其原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,某平衡体系中含有X、Y、Z、W四种物质,此温度下发生反应的平衡常数表达式为K= ![]() .有关该平衡体系的说法正确的是( )
.有关该平衡体系的说法正确的是( )
A.当混合气体的平均相对分子质量保持不变时,反应达平衡
B.增大压强,各物质的浓度不变
C.升高温度,平衡常数K增大
D.增加X的量,平衡既可能正向移动,也可能逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可充电的锂离子电池,以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池总反应为:Li+LiMn2O4=Li2Mn2O4。下列说法正确的是
A.放电时,LiMn2O4发生氧化反应
B.放电时,正极反应为:Li++LiMn2O4+e- =Li2Mn2O4
C.充电时,LiMn2O4发生氧化反应
D.充电时,阳极反应为:Li++e- =Li
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,海水的综合利用具有重要意义(如下图)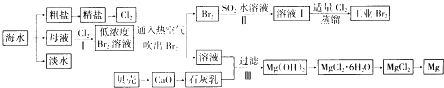
(1)氯碱工业主要以食盐为原料,为了除去粗盐中的Ca2+、Mg2+、SO42﹣及泥沙,可将粗盐溶于水,然后进行下列操作:①加过量的NaOH溶液;②加过量的BaCl2溶液③加过量的Na2CO3溶液;④过滤;⑤加适量的盐酸,第③步操作的目的是
(2)在实验室可以用萃取的方法提取溴,在萃取操作过程中,下列说法不正确的是 .
A.萃取剂可选用苯、CCl4、裂化汽油等有机溶剂.
B.萃取分液时下层液体从下口放出,上层液体从上口倒出
C.在萃取过程中,需要振荡分液漏斗,并打开分液漏斗上口的玻璃塞放气.
(3)通入热空气吹出溴,并用SO2的水溶液吸收的目的是 .
(4)步骤Ⅰ中用硫酸酸化可提高Cl2利用率的原因是 .
(5)步骤Ⅲ中有关反应的离子方程式 , 解释该反应能够发生的原因 .
(6)海水提溴蒸馏过程中,温度应控制在80﹣90℃,温度过高或过低都不利于生产,请解释原因 .
(7)工业上不用电解熔融MgO制金属镁,理由是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com