
����Ŀ��(1)��������16����������H2O ������ ��Mg ��CaO ������ ��Ca(OH)2 ��CuSO4��5H2O ����� ���ƾ� ��NaHCO3 Na2O2 CO SiO2 SO3 ���� Al(OH)3�����������ڻ������� (���������ͬ)��������������� _________����������� �������ε��� ���������ε��� �������л������ �������������������_____________�����ڼ������������_____________���������������������_________��
(2) ��1 mol H2SO4�й�����________����ԭ����H2SO4��Ħ������Ϊ_____________��
��________mol H2O�������е���ԭ������1.5 mol CO2�к��е���ԭ������ȡ�
��3.01��1023��O2�����ʵ�����________���������ʵ�����ȵij���(O3)��������ԭ��Ϊ________����
���𰸡�
(1) �ڢ����٢��������ߢ�����������������
(2) ��4NA ��98g/mol ����3����0.5mol��1.5NA
��������
���������(1)��16�������У���H2O �������������͵���������Ļ������Mg ��CaO�ܹ����ᷴӦ�����κ�ˮ�����ڼ���������������������Ca(OH)2���ڼ��CuSO4��5H2O�����Σ�������ǵ�ľƾ���Һ���ǻ������ƾ������л����NaHCO3������ʽ�Σ�Na2O2���ڹ������CO���ڲ����������SiO2�ܹ���Ӧ�����κ�ˮ��������������� SO3�ܹ���Ӧ�����κ�ˮ��������������� ��������̼���ƣ������Σ�Al(OH)3�ܹ���ǿ�ᷴӦ��Ҳ����ǿ�Ӧ�����������������������ڻ��������ڢ�����������������٢���������������������ε����ߢ����������ε������������л��������������������������������ڼ��������������������������������������ʴ�Ϊ���ڢ����٢��������ߢ�������������������
(2) ��1 mol H2SO4�й�������ԭ����=1 mol��4��NA/mol=4NA��H2SO4��Ħ������Ϊ98g/mol���ʴ�Ϊ��4NA ��98g/mol��
����ԭ������ȣ�������
2H2O����CO2��
2 1
n(H2O) 1.5mol
����![]() ��
��![]() ����֮�ã�n(H2O)=3mol���ʴ�Ϊ��3��
����֮�ã�n(H2O)=3mol���ʴ�Ϊ��3��
��3.01��1023��O2�����ʵ�����![]() =0.5mol���������ʵ�����ȵij���(O3)��������ԭ��Ϊ0.5mol��3��NA/mol=1.5NA���ʴ�Ϊ��0.5mol��1.5NA��
=0.5mol���������ʵ�����ȵij���(O3)��������ԭ��Ϊ0.5mol��3��NA/mol=1.5NA���ʴ�Ϊ��0.5mol��1.5NA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���� NA��ʾ�����ӵ�������ֵ������������ȷ���ǣ�
A. ���³�ѹ�£����� NA����ԭ�ӵĵ������ԼΪ 11.2L
B. ��״���£�64gSO2�к��е�ԭ����Ϊ 3NA
C. �ڳ��³�ѹ�£�11.2L Cl2���еķ�����Ϊ 0.5NA
D. ��״���£�11.2L H2O ���еķ�����Ϊ 0.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij���º��ݵ��ܱ������ڷ�����Ӧ��2A��g��+B��g��![]() C��g����H��0����ʼ����2mol A��2mol B�����ﵽƽ��״̬������˵����ȷ����
C��g����H��0����ʼ����2mol A��2mol B�����ﵽƽ��״̬������˵����ȷ����
A. �ٳ���2mol A��ƽ�����ƣ�A��ת��������
B. ��������¶ȣ�C�������������
C. �������ѹǿ����ѧƽ��һ��������Ӧ�����ƶ���B�����������С
D. �ٳ���1mol C��C�����ʵ���Ũ�Ƚ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������[aFe2(SO4��3��b(NH4��2SO4��cH2O]�㷺���ڳ�����������ˮ����ҵѭ��ˮ�ľ��������ȡ�ij����������������(��������������������Ϊԭ�ϣ���������¹���������ȡ������李�
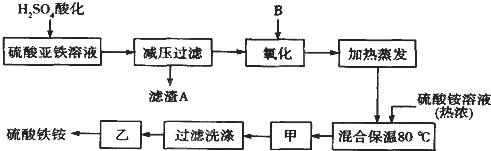
��ش��������⣺
��1������������Һ��H2SO4�ữ����ҪĿ���� ��
��2���������������ʺϵ�������B�� ��
a��NaClO b��H2O2 c��KMnO4 d��K2Cr2O7
��3�������������ǣ��� ��
��4�����������У�����֮��ͼ�������֮ǰ����ȡ���� (���Լ��Ļ�ѧʽ������Fe2+�Ƿ���ȫ����������
��5����ȡ14.00 g������Ʒ����������ˮ���Ƴ�100 mL��Һ���ֳ����ȷݣ�������һ���м�������NaOH��Һ������ϴ�ӵõ�2.14 g����������һ����Һ�м���0.05 mol Ba (NO3��2��Һ��ǡ����ȫ��Ӧ�����������淋Ļ�ѧʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѡ���У�ȫ���������ϸ���Ĵ���Ԫ�ص��ǣ� ��
A. P��N��Mn��K B. N��S��Zn��P
C. Fe��S��P��N D. Ca��N��P��K
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2.8g Feȫ������һ��Ũ�ȡ�200mL��HNO3��Һ�У��õ���״���µ�����1.12L����÷�Ӧ����Һ��pHΪ1������Ӧǰ����Һ����仯���Բ��ƣ������й��ж���ȷ����
A����Ӧ����Һ��c��NO3����=0.85mol/L
B����Ӧ�����Һ�����ܽ�1.4gFe
C����Ӧ����Һ����Ԫ�ؿ�����Fe2+��ʽ����
D��1.12L���������NO��NO2�Ļ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25 ��ʱ�����и���������ָ����Һ��һ���ܴ����������( ��
A��pH��1����Һ�У�Na����K����MnO![]() ��CO
��CO![]()
B��c(H������1��10��13 mol��L��1����Һ�У�Mg2����Cu2����SO![]() ��NO
��NO![]()
C��0.1 mol��L��1 NH4HCO3��Һ�У�K����Na����NO![]() ��Cl��
��Cl��
D��0.1 mol��L��1 FeCl3��Һ�У�Fe2����NH![]() ��SCN����SO
��SCN����SO![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ��þ�ĺϽ�2.14g��ȫ����һ��Ũ�ȵ����ᣬ����Ӧ�����ᱻ��ԭΪNO2��NO��N2O������������ڱ�״�������ǵ������Ϊ0.224 L���ڷ�Ӧ�����Һ�У���������������������Һ�����ɵij��������ˡ�ϴ�ӡ����¸�������������Ϊ�� ��
A��4.18g B��3.12g C��4.68g D��5.08g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Һ�����Ե���
A. HClO��Һ B. NH4NO3��Һ C. BaCl2��Һ D. NaHCO3��Һ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com