
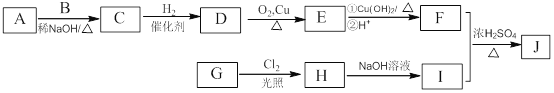
【题目】下图是中学化学中常见物质的转化关系,部分物质和反应条件略去。

(1)单质F的化学式是_______________。
(2)写出单质B与强碱溶液反应的离子方程式___________________________,写出由沉淀J生成H溶液的离子方程式______________________________________。
(3)溶液E中加入氨水时,先生成白色沉淀L,写出生成L的离子方程式:____________________________________________,白色沉淀L最终变为红褐色沉淀G,写出L变为G的化学反应方程式______________________________。
(4)溶液I中所含金属离子是__________________。
【答案】 H2 2Al+2OH-+2H2O===2AlO![]() +3H2↑ Al(OH)3+OH-===AlO
+3H2↑ Al(OH)3+OH-===AlO![]() +2H2O Fe2++2NH3·H2O===Fe(OH)2↓+ 2NH4+ 4Fe(OH)2+O2+2H2O===4Fe(OH)3 Na+、Al3+
+2H2O Fe2++2NH3·H2O===Fe(OH)2↓+ 2NH4+ 4Fe(OH)2+O2+2H2O===4Fe(OH)3 Na+、Al3+
【解析】金属B与强碱反应得到单质F与H,则B为Al、F为H2,H为偏铝酸盐,G为红褐色沉淀,则G为Fe(OH)3,红棕色物质A与金属Al发生置换反应生成单质C与氧化物D,则A为Fe2O3、C为Fe、D为Al2O3,由转化关系可知,E为FeCl2,H为NaAlO2,溶液I为NaCl、HCl、AlCl3混合物,J为Al(OH)3,则
(1)由上述分析可知,单质F的化学式是H2;(2)单质Al与强碱溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO![]() +3H2↑,由沉淀J生成 H溶液的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O;(3)溶液FeCl2中加入氨水时,先生成白色沉淀L为氢氧化亚铁,离子方程式:Fe2++2NH3·H2O=Fe(OH)2↓+ 2NH4+,白色沉淀会迅速变为灰绿色,最终变为红褐色沉淀,L变为G的化学反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;(4)溶液I为NaCl、HCl、AlCl3混合物,所含金属离子是Na+、Al3+。
+3H2↑,由沉淀J生成 H溶液的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O;(3)溶液FeCl2中加入氨水时,先生成白色沉淀L为氢氧化亚铁,离子方程式:Fe2++2NH3·H2O=Fe(OH)2↓+ 2NH4+,白色沉淀会迅速变为灰绿色,最终变为红褐色沉淀,L变为G的化学反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;(4)溶液I为NaCl、HCl、AlCl3混合物,所含金属离子是Na+、Al3+。


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:
【题目】某溶液中可能含有Na+、NH4+、Ba2+、SO42-、I-、S2-中的几种。①用pH试纸测试,溶液显弱酸性;②加氯水和淀粉无明显现象。为确定该溶液的组成,还需检验的离子是
A. Na+ B. SO42- C. Ba2+ D. NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C3H6O2的有机物有多种同分异构体,现有其中的四种X、Y、Z、W,它们的分子中均含甲基,将它们分别进行下列实验以鉴别,其实验记录如下:
NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 | 金属钠 | |
X | 中和反应 | 无现象 | 溶解 | 产生氢气 |
Y | 无现象 | 有银镜 | 加热后有砖红色沉淀 | 产生氢气 |
Z | 水解反应 | 有银镜 | 加热后有砖红色沉淀 | 无现象 |
W | 水解反应 | 无现象 | 无现象 | 无现象 |
回答下列问题:
(1)写出X的结构简式________, W的系统命名是________.
(2)①Y在一定条件下发生分子内的脱水反应的化学方程式_________________________
②Z与NaOH溶液反应的化学方程式_______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辣椒素是辣椒的活性成分,可在口腔中产生灼烧感,能够起到降血压和胆固醇的功效,进而在很大程度上预防心脏病,也能缓解肌肉关节疼痛。辣椒素酯类化合物的结构可以表示为:
 (R为烃基)
(R为烃基)
其中一种辣椒素酯类化合物J的合成路线如下:
已知:
①A、B和E为同系物,其中B的相对分子质量为44,A和B核磁共振氢谱显示都有两组峰;
②化合物J的分子式为C15H22O4;
③
回答下列问题:
(1)G所含官能团的名称为 。
(2)由A和B生成C的化学方程式为 。
(3)由C生成D的反应类型为 ,D的化学名称为 。
(4)由H生成I的化学方程式为 。
(5)J的结构简式为 。
(6)G的同分异构体中,苯环上的一氯代物只有一种的共有 种(不含立体异构),核磁共振氢谱显示2组峰的是 (写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2![]() Cu2S+2FeS+SO2,下列说法正确的是
Cu2S+2FeS+SO2,下列说法正确的是
A. SO2仅为氧化产物 B. CuFeS2仅作还原剂,硫元素被氧化
C. 每转移6mol电子,有1mol硫被氧化 D. 每生成0.5molCu2S,有2mol硫被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种优良的消毒剂,浓度过高时易发生分解,常将其制备成NaClO2固体以便运输和贮存。过氧化氢法制备NaClO2固体的实验装置如图1所示。
已知:2NaClO3+H2O2+H2SO4===2ClO2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH===2NaClO2+O2↑+2H2O
ClO2熔点-59 ℃、沸点11 ℃;H2O2沸点150 ℃

图1
请回答:
(1)仪器A的作用是___________________________________________;冰水浴冷却的目的是____________________________________(写出两种)。
(2)空气流速过快或过慢,均降低NaClO2产率,试解释其原因______________________________________。
(3)Cl-存在时会催化ClO2生成。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步反应完成,将其补充完整:
①________________________________________________________________________
(用离子方程式表示),②H2O2+Cl2===2Cl-+O2+2H+。
(4)H2O2浓度对反应速率有影响。通过图2所示装置将少量30%H2O2溶液浓缩至40%,B处应增加一个设备。该设备的作用是________,馏出物是________。

图2
(5)抽滤法分离NaClO2过程中,下列操作不正确的是________。
A.为防止滤纸被腐蚀,用玻璃纤维代替滤纸进行抽滤
B.先转移溶液至漏斗,待溶液快流尽时再转移沉淀
C.洗涤沉淀时,应使洗涤剂快速通过沉淀
D.抽滤完毕,断开水泵与吸滤瓶间的橡皮管后,关闭水龙头
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A. 乙烯使溴水褪色是因为发生了加成反应
B. 二氧化硫使溴水褪色是因为发生了氧化还原反应
C. 用乙酸和乙醇反应制备乙酸乙酯发生了酯化反应
D. 乙酸乙酯在酸性条件下的水解反应程度更大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A和B两种有机物可以互溶,有关性质如下
密度(20℃) | 熔点(℃) | 沸点(℃) | 溶解性 | |
A | 0.7893 | -117.3 | 78.5 | 与水以任意比混溶 |
B | 0.7137 | -116.6 | 34.5 | 不溶于水 |
(1)要除去A和B的混合物中的少量B,可采用________方法即可得到A。
A.蒸馏 B.重结晶 C.萃取 D.加水充分振荡,分液
(2)将有机物A置于氧气流中充分燃烧,A和氧气恰好完全反应消耗氧气6.72L(标准状况),生成5.4g H2O和8.8g CO2,则该物质的分子式是______;已知有机物A的核磁共振氢谱如下图所示,则A的结构简式为_______________。以A为原料可以合成M,M可做内燃机的抗冻剂,M与A所含碳原子数相等,M的官能团与A相同,但官能团数目是A的两倍,请写出以A为原料制取M的合成路线:_______________。

(3)若质谱图显示B的相对分子质量为74,红外光谱如图所示,则B的结构简式为____________。

(4)准确称取一定质量的A和B的混合物,在足量氧气中充分燃烧,将产物依次通过足量的无水氯化钙和碱石灰,发现质量分别增重14.4g和26.4g。计算混合物中A和B的物质的量之比___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com