
【题目】甲烷水蒸气重整和水气变换是传统的制氢方法,反应如下 :
①CH4(g)+H2O(g)CO(g)+3H2 (g) △H1= 206kJmol-1
②CO(g)+H2O(g)CO2(g)+H2(g) △H2= - 4 1 kJmol-1
近期报道,用二氧化碳作为氧化剂和甲烷重整制氢的新反应路线如下,可生成适宜 H2/ CO 的合成气。
③CH4 (g)+CO2 (g)2CO(g)+2H2(g) △H3
(1)下列措施最有利于提高反应③CH4的平衡转化率条件是______________。
A. 升高温度,同时对原料气进行加压 B. 降低温度,同时对原料气进行加压
C. 升高温度,同时用氩气稀释原料气 D. 降低温度,同时用氩气稀释原料气
(2)重整反应器中以上三个反应都在发生,不同反应条件下达到平衡时的进程如下:
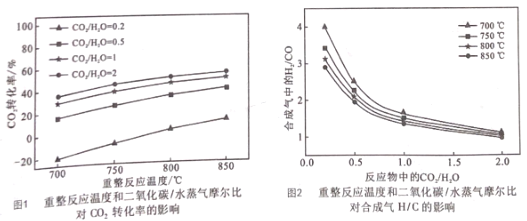
I.根据图1,在_________ ( 填写反应条件)时CO2的转化率为负值,主要原因:一是 CO2稳定性较高,低浓度时难以和甲烷反应;二是 ___________。
II.根据图,2随着反应温度和反应物中![]() 的提高,体系中反应____填①、②、③)逐渐占据主导。若 850℃、
的提高,体系中反应____填①、②、③)逐渐占据主导。若 850℃、![]() 为0.5时重整反应器中达到平衡时,体系中CO2和水蒸气浓度相等,求此条件下反应②的平衡常数K=__。
为0.5时重整反应器中达到平衡时,体系中CO2和水蒸气浓度相等,求此条件下反应②的平衡常数K=__。
(3)固体氧化物电解池(传导O2-)将CO2 和H2O 转化为n(H2):n(CO)=1的合成气并联产高纯度O2,写出电解池阴极反应式__________________。
【答案】C Ⅰ.反应温度低于 800℃、二氧化碳水蒸气摩尔比等于 0.2 相对较多的 H2O(g)以及较低的温度,使反应②平衡正向移动,反应③平衡逆向移动,CO2浓度上升 ③ 2 CO2+H2O+4e-=CO+H2+2O2-
【解析】
(1)根据盖斯定律判断反应③是吸热还是放热反应,提高CH4的平衡转化率,平衡正向移动,据此分析;
(2)I.结合图像1曲线的位置分析CO2的转化率为负值的条件;根据![]() 比值中,二氧化碳和水蒸气的所占比例对平衡移动的影响分析;
比值中,二氧化碳和水蒸气的所占比例对平衡移动的影响分析;
II.在![]() 不变的条件下,升高温度
不变的条件下,升高温度![]() 比值减小,反应②为放热反应,升高温度,平衡逆向移动;结合图像数据对应点数据,求解反应②平衡常数K;
比值减小,反应②为放热反应,升高温度,平衡逆向移动;结合图像数据对应点数据,求解反应②平衡常数K;
(3)根据题意,该电解池的总反应为CO2+H2O![]() H2+CO+O2,电解池中阳极失电子被氧化,阴极得电子被还原。
H2+CO+O2,电解池中阳极失电子被氧化,阴极得电子被还原。
(1)已知:①CH4(g)+H2O(g)CO(g)+3H2 (g) △H1= 206kJmol-1
②CO(g)+H2O(g)CO2(g)+H2(g) △H2= - 41 kJmol-1
根据盖斯定律,①-②=③,则③CH4 (g)+ CO2 (g) 2CO(g)+ 2H2(g) △H3=△H1-△H2=247 kJmol-1,故反应③是吸热反应,且正反应方向是气体体积增大的反应体系,要提高CH4的平衡转化率,则平衡需要正向移动,方法为升高温度,同时用氩气稀释原料气,答案选C;
(2)I.结合图像1曲线的位置分析CO2的转化率为负值的条件为:反应温度低于 800℃、![]() =0.2;
=0.2;![]() =0.2,说明水蒸气的含量大,相对较多的 H2O(g)以及较低的温度,使反应②平衡正向移动,反应③平衡逆向移动,CO2浓度上升;
=0.2,说明水蒸气的含量大,相对较多的 H2O(g)以及较低的温度,使反应②平衡正向移动,反应③平衡逆向移动,CO2浓度上升;
II.在![]() 不变的条件下,三个反应中,反应②为放热反应,升高温度,平衡逆向移动,氢气的量减少,一氧化碳的量增大,升高温度
不变的条件下,三个反应中,反应②为放热反应,升高温度,平衡逆向移动,氢气的量减少,一氧化碳的量增大,升高温度![]() 比值减小,升高温度反应①③正向移动,由于图像走向,
比值减小,升高温度反应①③正向移动,由于图像走向,![]() 比值趋向于1,故起主导的为反应③;
比值趋向于1,故起主导的为反应③;
若850℃、![]() 为 0. 5 时,,重整反应器中达到平衡时,体系中 CO2和水蒸气浓度相等,此时曲线上
为 0. 5 时,,重整反应器中达到平衡时,体系中 CO2和水蒸气浓度相等,此时曲线上![]() =2,即
=2,即![]() =2,反应CO(g)+ H2O(g)CO2(g) +H2(g) 的平衡常数K=
=2,反应CO(g)+ H2O(g)CO2(g) +H2(g) 的平衡常数K=![]() =2;
=2;
(3)根据题意,该电解池的总反应为CO2+H2O![]() H2+CO+O2,电解池中阳极失电子被氧化,阴极得电子被还原,固体氧化物电解池(传导O2-),阳极:2O2—4e-=O2,总反应减去阳极反应可得阴极反应为:CO2+H2O+4e-=CO+H2+2O2-。
H2+CO+O2,电解池中阳极失电子被氧化,阴极得电子被还原,固体氧化物电解池(传导O2-),阳极:2O2—4e-=O2,总反应减去阳极反应可得阴极反应为:CO2+H2O+4e-=CO+H2+2O2-。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】无水三氯化铬(CrCl3)为紫色晶体,在工业上主要用作媒染剂和催化剂,某化学小组用Cr2O3和CCl4在高温下制备无水三氯化铬,部分实验装置如图所示。
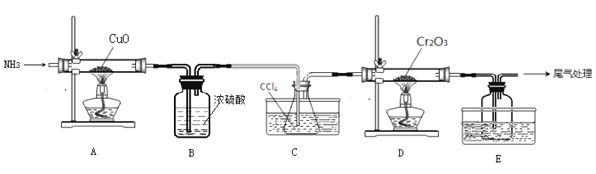
已知:①CrCl3熔点为83℃,易潮解,易升华,易溶于水但不易水解,高温下易被氧气氧化;②Cr2O3和CCl4在高温下反应的产物为CrCl3和光气(COCl2 )。请回答下列问题:
(1)装置A是氮气制备装置,氮气的作用是____________。
(2)装置B的作用为________。装置C和装置E的水槽中应分别盛有__________、____________。
(3)装置D中生成CrCl3和光气(COCl2 )的化学方程式为_________。
(4)该实验装置有设计不合理的地方,请写出改进方法:_________(写一点即可)
(5)产品中CrCl3质量分数的测定:
(i)称取0.3000 g得到的CrCl3样品溶于水并于250mL容量瓶中定容。
(ii)取25.00mL样品溶液于带塞的锥形瓶中,加热至沸腾后加入稍过量的Na2O2,稀释并加热煮沸,再加入过量的H2SO4酸化,将Cr3+氧化为Cr2O72-;再加入过量的KI固体,加塞摇匀,使铬完全以Cr3+形式存在
(iii)加入1mL指示剂,用0.0250 mol·L-1标准Na2S2O3溶液滴定至终点,平行测定三次,平均消耗标准Na2S2O3溶液21.00mL(已知2Na2S2O3+I2= Na2S4O6+2NaI)
①ii中加入稍过量的Na2O2后要加热煮沸,其主要原因是____________;加入KI发生反应的离子方程式为________________
②滴定实验可选用的指示剂为____________产品中CrCl3质量分数为_______%(结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通干电池是一种广泛使用的可移动化学电源。 某同学在探究废酸性干电池内物质回收利用时,进行如图所示实验:
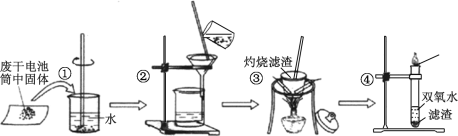
请回答以下问题:
(1)干电池工作时正极电极反应式为:2NH4++2e- = 2NH3↑+H2↑,则负极电极反应式是___________。 电池中加入 MnO2 的作用是除去正极上的某产物, 本身生成Mn2O3,该反应的化学方程式是_______________。
(2)步骤③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、______ 、泥三角和三脚架;灼烧滤渣时,产生一种无色无味能使澄清石灰水变浑浊的气体,由此推测灼烧前的滤渣中存在的物质有_____。
(3)向步骤④的试管中加入步骤③灼烧后所得黑色固体,试管中迅速产生能使带火星的木条复燃的气体,据此可初步认定灼烧后的黑色固体为_____。
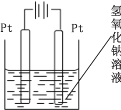
(4)查询资料得知,通过电解可将 Mn2O3 转化为 MnO2。 为此某同学设计了如图所示装置,并将混合物粉末调成糊状,附在其中的_________(填“左”或“右”)边电极上,该电极上发生反应的电极反应式是_____, 在电解过程中溶液的 pH 将__________(填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式不正确的是
A.用氨水吸收过量的二氧化硫:![]()
B.向0.5mol L-1 KAl(SO4)2溶液中滴入0.5mol L-1 Ba(OH)2溶液使![]() 恰好完全沉淀:2Ba2+ 4OH- + Al3++2
恰好完全沉淀:2Ba2+ 4OH- + Al3++2![]() =2BaSO4↓+
=2BaSO4↓+![]() +2H2O
+2H2O
C.用足量Na2S2O3溶液除去水中的 Cl2: 4Cl2+![]() +5H2O =10H++2
+5H2O =10H++2![]() +8Cl-
+8Cl-
D.少量CO2通入苯酚钠溶液中:C6H5O-+CO2+H2O→C6H5OH+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液X 中含有下表中离子若干种,且离子浓度均为相等(不考虑水的电离与离子水解)。向X 中加入足量稀盐酸,有无色气体生成, 经分析反应前后阴离子种类没有变化,下列说法正确的是
阳离子 | Na+、Ca2+ 、Fe3+、Fe2+、Al3+、Mg2+ |
阴离子 | OH-、 |
A.溶液X 中可能有![]() 或
或![]() 中的一种或两种都有
中的一种或两种都有
B.溶液X 中是否有Na+不能确定,需通过焰色反应来确定
C.溶液X 中可能有2 种阳离子,3 种阴离子
D.原溶液一定没有Al3+、Fe 3+,但Na+,、![]() 不确定
不确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】迄今为止我国相关部门已经发布了113号Nh、115号Mc、116号Lv、117号Ts、118号Og等元素的中文名称分别是:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,下列有关推断正确的是( )
,下列有关推断正确的是( )
A.这五种元素均为主族元素
B.Nh的最高价氧化物是一种典型的两性氧化物
C.Ts的简单阴离子比该族上一周期简单阴离子的还原性弱
D.根据该名称,周期表118种元素中非金属元素共有24种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10min内,相同浓度的有机污染物X的降解率随pH和温度的关系如图1和图2所示。
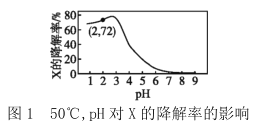
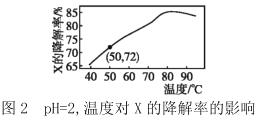
下列说法不正确的是( )
A.50℃,pH=4时X降解速率大于pH=5时的降解速率
B.由图1和图2可知,随温度的升高和pH的增大X的降解率不一定增大
C.由图1和图2可判断反应最佳条件:pH=3,温度为80℃
D.若50℃,pH=2时降解速率v(X)=1.44×10-4mol·L-1·min-1,则初始c(X)=2.0×10-3mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,人们对环境保护、新能源开发很重视。
(1)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体:4CO(g)+2NO2(g) ![]() 4CO2(g)+N2(g)。恒温恒容条件下,能够说明该反应已达到平衡状态的是________
4CO2(g)+N2(g)。恒温恒容条件下,能够说明该反应已达到平衡状态的是________![]() 填字母代号
填字母代号![]() 。
。
A.容器内混合气体颜色不再变化
B.容器内的压强保持不变
C.2V逆(NO2)=V正(N2)
D.容器内混合气体密度保持不变
(2)用活性炭还原法也可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g)△H时,反应进行到不同时间测得各物质的量浓度如下表所示:
N2(g)+CO2(g)△H时,反应进行到不同时间测得各物质的量浓度如下表所示:
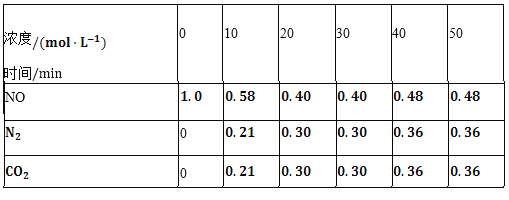
①根据表中数据分析T1℃时,该反应在0~20min的平均反应速率v(CO2)________;计算该反应的平衡常数![]() ________。
________。
②根据上表数据判断,由30min到40min时改变的条件可能是________![]() 任写一种
任写一种![]() 。
。
③若30min后升高温度至T2℃,达到新平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,此时NO的转化率________![]() 填“升高”或“降低”
填“升高”或“降低”![]() ,△H________
,△H________![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() 。(3)以
。(3)以![]() 与
与![]() 为原料可合成化肥尿素化学式为
为原料可合成化肥尿素化学式为![]() 。已知:①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5kJ/mol②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+116.5kJ/mol,③H2O(l)=H2O(g)△H=+44.0kJ/mol,写出CO2与NH3合成尿素和液态水的热化学方程式_____
。已知:①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5kJ/mol②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+116.5kJ/mol,③H2O(l)=H2O(g)△H=+44.0kJ/mol,写出CO2与NH3合成尿素和液态水的热化学方程式_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写及评价,均合理的是
选项 | 离子方程式 | 评价 |
A | 用铜电极电解饱和KCl溶液:2H2O+2Cl- | 正确:Cl-的失电子能力比OH-强 |
B | 向CuSO4溶液中通入过量的H2S气体:Cu2++H2S=CuS↓+2H+ | 错误:H2S的酸性比H2SO4弱 |
C | Ba(HCO3)2溶液与足量的NaOH溶液反应:Ba2++HCO3- +OH- ═BaCO3↓+H2O | 错误:Ba2+与HCO3-系数比应为1:2 |
D | 过量SO2通入到NaClO溶液中:SO2+ClO- +H2O= HClO+HSO3- | 正确:H2SO3的酸性比HClO强 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com