
【题目】普通干电池是一种广泛使用的可移动化学电源。 某同学在探究废酸性干电池内物质回收利用时,进行如图所示实验:
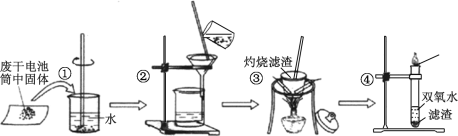
请回答以下问题:
(1)干电池工作时正极电极反应式为:2NH4++2e- = 2NH3↑+H2↑,则负极电极反应式是___________。 电池中加入 MnO2 的作用是除去正极上的某产物, 本身生成Mn2O3,该反应的化学方程式是_______________。
(2)步骤③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、______ 、泥三角和三脚架;灼烧滤渣时,产生一种无色无味能使澄清石灰水变浑浊的气体,由此推测灼烧前的滤渣中存在的物质有_____。
(3)向步骤④的试管中加入步骤③灼烧后所得黑色固体,试管中迅速产生能使带火星的木条复燃的气体,据此可初步认定灼烧后的黑色固体为_____。
(4)查询资料得知,通过电解可将 Mn2O3 转化为 MnO2。 为此某同学设计了如图所示装置,并将混合物粉末调成糊状,附在其中的_________(填“左”或“右”)边电极上,该电极上发生反应的电极反应式是_____, 在电解过程中溶液的 pH 将__________(填“变大”、“变小”或“不变”)。
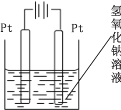
【答案】Zn-2e-= Zn2+ 2MnO2+H2=Mn2O3+H2O 坩埚 C(碳) 二氧化锰(MnO2) 左 Mn2O3+2OH--2e-=2MnO2+H2O 变大
【解析】
(1) 在锌锰干电池中,活泼金属锌为电池负极,反应式为Zn-2e-= Zn2+,MnO2生成Mn2O3,该过程中的Mn化合价降低,被还原,还原剂就是正极产物氢气,反应式为2MnO2+H2= Mn2O3+H2O;
(2) 灼烧操作需要坩埚,转移坩埚需要坩埚钳,坩埚需要放置在三脚架或铁架台的铁圈上的泥三角中,灼烧过程中要用玻璃棒搅拌,则还缺少的仪器为坩埚;无色无味能使澄清石灰水变浑浊的气体为二氧化碳,说明分离出的固体残渣中含有碳单质(C);
(3)双氧水在催化剂二氧化锰作用下可快速释放出氧气,氧气能使带火星的木条复燃,则灼烧产生的黑色固体中含有二氧化锰;
(4)以通过电解的方式,将Mn2O3转化为MnO2,在阳极上失去电子实现转化,由图可知,左侧与电源正极相连为阳极,则将混合物粉末调成糊状,附在其中的左边电极上,该电极上发生的电极反应式是:Mn2O3-2e+2OH=2MnO2+H2O,阴极氢离子放电,2H2O+2e=2OH+H2↑,总反应消耗水,最终氢氧根离子浓度增大,则在电解过程中溶液的pH将变大。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】重铬酸钠晶体 ![]() 俗称红矾钠,在工业方面有广泛用途.我国目前主要是以铬铁矿
俗称红矾钠,在工业方面有广泛用途.我国目前主要是以铬铁矿![]() 主要成份为
主要成份为![]() ,还含有
,还含有![]() 、MgO、
、MgO、![]() 等杂质
等杂质![]() 为主要原料进行生产,其主要工艺流程如下:
为主要原料进行生产,其主要工艺流程如下:
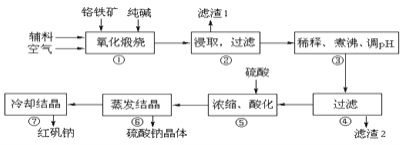
①中涉及的主要反应有:
主反应:![]()
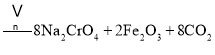
副反应: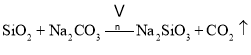 、
、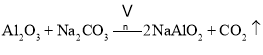
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
沉淀物 |
|
|
|
|
完全沉淀时溶液pH |
|
|
|
|
试回答下列问题:/span>
![]() “①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 ______
“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 ______
![]() “③”中调节pH至
“③”中调节pH至![]() ,目的是 ______ .
,目的是 ______ .
![]() “⑤”中加硫酸酸化的目的是使
“⑤”中加硫酸酸化的目的是使![]() 转化为
转化为![]() ,请写出该平衡转化的离子方程式: ______ .
,请写出该平衡转化的离子方程式: ______ .
![]() 称取重铬酸钠试样
称取重铬酸钠试样![]() 配成250mL溶液,取出
配成250mL溶液,取出![]() 于碘量瓶中,加入10mL
于碘量瓶中,加入10mL![]() 和足量碘化钠
和足量碘化钠![]() 铬的还原产物为
铬的还原产物为![]() ,放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用
,放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用![]() 标准溶液滴定
标准溶液滴定![]()
①判断达到滴定终点的依据是: ______ ;
②若实验中共用去![]() 标准溶液
标准溶液![]() ,所得产品的中重铬酸钠晶体的纯度
,所得产品的中重铬酸钠晶体的纯度![]() 设整个过程中其它杂质不参与反应
设整个过程中其它杂质不参与反应![]() ______ .
______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铬(Cr2O3)可用作有机合成的催化剂。某课题组以铬铁矿为主要原料制备Cr2O3。铬铁矿主要成分为Fe(CrO2)2,还含有Al2O3、SiO2等杂质,工艺流程如图所示。下列说法错误的是( )
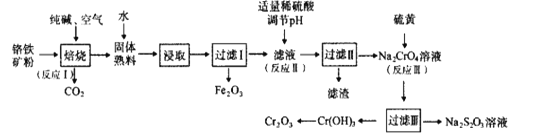
A.Fe(CrO2)2中Cr元素的化合价为+3
B.“焙烧”时,1molFe(CrO2)2参加反应转移4mole-
C.“滤渣”成份是Al(OH)3
D.“反应Ⅲ”的离子方程式为4CrO42-+6S+7H2O=4Cr(OH)3+3S2O32-+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学涉及多种常数。 下列说法正确的是
A.两种物质反应,不管怎样书写化学方程式,平衡常数不变
B.对于反应:3A(g)+2B(g) 4C(s)+2D(g)的化学平衡常数表达式为 K= ![]()
C.KW 不是水的电离平衡常数
D.难溶电解质 AB2 饱和溶液中,c(A2+)=x mol·L-1,c(B-)=y mol·L-1,则 Ksp 值为 4xy2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米Fe3O4在生物医学和催化剂载体等领域应用前景光明。其制备流程如下:
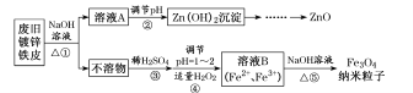
已知:锌单质溶于强碱生成ZnO22-;Zn(OH)2既能溶于强酸又能溶于强碱。
请回答下列问题:
(l)用NaOH溶液处理废旧锌铁皮的作用有___。
A.去除油污 B.溶解镀锌层 C.去除铁锈 D.钝化
(2)步骤②生成Zn(OH)2沉淀的离子方程式为____,用离子方程式结合文字说明该步骤pH不能过小的原因____。调节pH的最佳方法是向溶液中通入____(填化学式)。
(3)步骤④反应的离子方程式为_____;为确保纳米Fe3O4粒子的纯度,应调整原溶液中Fe2+与所加H2O2的物质的量之比为_______。
(4)步骤⑤制得Fe3O4纳米粒子的过程,需要在无氧环境下进行,说明理由__________;T业生产中可采取___________措施提供无氧环境。
(5)步骤⑤ _______(填“能”或“不能”)用减压过滤(抽滤)得到纳米Fe3O4粒子?理由是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳捕集与封存是应对气候变化问题的解决方案之一。回答下列问题:
(l)我国科研团队利用低温等离子体协同催化技术,在常温常压下实现了将CO2和CH4一步转化为化工产品。试写出 CO2与CH4合成乙酸的热化学方程式:____。
(甲烷和乙酸的燃烧热分别为-890.31 kJ/mol、-876.72 kJ/mol)
(2)在某一钢性密闭容器中CH4、CO2的分压分别为15 kPa、20 kPa,加入Ni/α-Al2 O3催化剂并加热至1123 K使其发生反应:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
①研究表明CO的生成速率v(CO)=1.28![]() 10-2﹒p(CH4)
10-2﹒p(CH4)![]() p(CO2)(kPa
p(CO2)(kPa![]() s-1),某时刻测得p(H2)=10 kPa,则 p(CH4)=___kPa,v(CO)=___kPa
s-1),某时刻测得p(H2)=10 kPa,则 p(CH4)=___kPa,v(CO)=___kPa![]() s-1。
s-1。
②达到平衡后测得体系压强是起始时的![]() ,则该反应的平衡常数Kp=____kPa)2。
,则该反应的平衡常数Kp=____kPa)2。
(3)氮化镓(GaN)与Cu可组成如图所示的人工光合系统,该装置能以CO2和H2O为原料合成CH4。
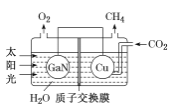
①该装置工作时H+移向____(填“GaN”或“Cu”)电极,该电极上的电极反应式为 ___。
②该装置每产生1 mol CH4,左极室溶液质量减少____g。
③本实验条件下,若CO2转化为烃(如甲烷、乙烯等)的转化率为10%,生成CH4的选择性为12%,现收集到12 mol CH4,则通入的CO2为____mol。(已知:选择性=生成目标产物消耗的原料量/原料总的转化量)
(4)上述人工光合系统装置也可以制备乙烯、乙炔等重要化工原料。2010年Sheth等研究得出乙炔在Pd表面选择加氢的反应机理,如下图所示。其中吸附在Pd表面的物质用“*”标注。
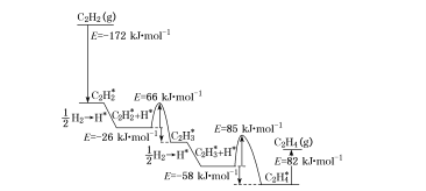
上述吸附反应为 ____填“吸热”或“放热”)反应,该过程中最小能垒(活化能)为___ kJ![]() mol-1,该步骤的化学方程式为____。
mol-1,该步骤的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃ 时,在一容积为 2 L 的恒容密闭容器中加入 2 mol A 和 3 mol B,压强为 P0, 在催化剂存在的条件下进行下列反应:2A(g)+3B(g) 3C(g),2 分钟达到平衡,平衡混合气中 C 的体积分数为 37.5%。 已知该反应某一时刻的瞬时速率计算公为v正=k正·[A]2·[B]3,v逆=k逆·[C]3,其中 k正、k逆为速率常数。
(1)计算上述条件下 ![]() 的值。 (写出必要的计算过程,下同)_____
的值。 (写出必要的计算过程,下同)_____
(2)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数,记作 Kp。已知某气体分压(P分)=气体总压(P总) ×该气体的物质的量分数,计算 T℃ 时上述反应 Kp 的值(用含 P0 的数值表示)。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷水蒸气重整和水气变换是传统的制氢方法,反应如下 :
①CH4(g)+H2O(g)CO(g)+3H2 (g) △H1= 206kJmol-1
②CO(g)+H2O(g)CO2(g)+H2(g) △H2= - 4 1 kJmol-1
近期报道,用二氧化碳作为氧化剂和甲烷重整制氢的新反应路线如下,可生成适宜 H2/ CO 的合成气。
③CH4 (g)+CO2 (g)2CO(g)+2H2(g) △H3
(1)下列措施最有利于提高反应③CH4的平衡转化率条件是______________。
A. 升高温度,同时对原料气进行加压 B. 降低温度,同时对原料气进行加压
C. 升高温度,同时用氩气稀释原料气 D. 降低温度,同时用氩气稀释原料气
(2)重整反应器中以上三个反应都在发生,不同反应条件下达到平衡时的进程如下:
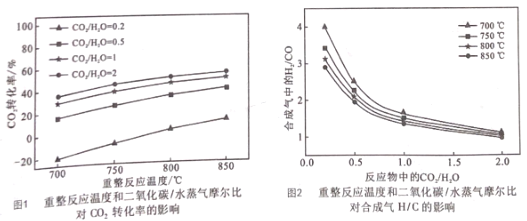
I.根据图1,在_________ ( 填写反应条件)时CO2的转化率为负值,主要原因:一是 CO2稳定性较高,低浓度时难以和甲烷反应;二是 ___________。
II.根据图,2随着反应温度和反应物中![]() 的提高,体系中反应____填①、②、③)逐渐占据主导。若 850℃、
的提高,体系中反应____填①、②、③)逐渐占据主导。若 850℃、![]() 为0.5时重整反应器中达到平衡时,体系中CO2和水蒸气浓度相等,求此条件下反应②的平衡常数K=__。
为0.5时重整反应器中达到平衡时,体系中CO2和水蒸气浓度相等,求此条件下反应②的平衡常数K=__。
(3)固体氧化物电解池(传导O2-)将CO2 和H2O 转化为n(H2):n(CO)=1的合成气并联产高纯度O2,写出电解池阴极反应式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明许多疾病,包括基因突变(癌变、动脉硬化等)和生物机体中毒等,可能是一氧化氮的释放或调节不正常引起的。用间接电化学法可对NO进行无害化处理,其原理如图所示(质子膜允许H+和H2O通过),下列相关判断不正确的是 ( )
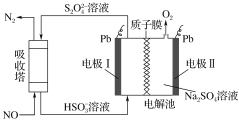
A.电极Ⅰ接电源负极,电极反应式为2HSO3-+2H++2e-==S2O42-+2H2O
B.质子从电极Ⅱ通过质子膜向电极Ⅰ作定向移动
C.吸收塔中的反应为2NO+2S2O42-+2H2O==N2+4HSO3-
D.每处理2 mol NO,电解池质量减少32 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com