
【题目】T℃ 时,在一容积为 2 L 的恒容密闭容器中加入 2 mol A 和 3 mol B,压强为 P0, 在催化剂存在的条件下进行下列反应:2A(g)+3B(g) 3C(g),2 分钟达到平衡,平衡混合气中 C 的体积分数为 37.5%。 已知该反应某一时刻的瞬时速率计算公为v正=k正·[A]2·[B]3,v逆=k逆·[C]3,其中 k正、k逆为速率常数。
(1)计算上述条件下 ![]() 的值。 (写出必要的计算过程,下同)_____
的值。 (写出必要的计算过程,下同)_____
(2)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数,记作 Kp。已知某气体分压(P分)=气体总压(P总) ×该气体的物质的量分数,计算 T℃ 时上述反应 Kp 的值(用含 P0 的数值表示)。____________
【答案】4 ![]()
![]()
【解析】
(1)利用“三段式”计算出平衡常数K,根据已知条件v正=k正·[A]2·[B]3,v逆=k逆·[C]3,平衡时正逆反应速率相等,列式解答;
(2)各物质分压=总压×平衡时各物质的物质的量分数,据此书写压强表示的平衡常数。
(1)设达到平衡时 A 转化的物质的量为 x mol
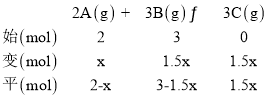
由题知![]() ×100%=37.5%得 x=1,
×100%=37.5%得 x=1,![]() ,反应达到平衡时满足 v正=v逆,即 k正[A]2[B]3=k逆[C]3,得
,反应达到平衡时满足 v正=v逆,即 k正[A]2[B]3=k逆[C]3,得![]() =K=4;
=K=4;
(2)平衡时 n(A)=1 mol,n(B)=1.5 mol,n(C)=1.5 mol,A、B、C 气体的物质的量分数分别为 25%,37.5%,37.5%。起始压强为 P0,则达平衡后压强为 0.8P0,则Kp=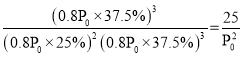 。
。


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是二元弱酸,NaHC2O4溶液呈酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系错误的是( )
A.V(NaOH) = 0时,c(H+) >1×10-7mol/L
B.V(NaOH)<10 mL时,可能存在c(Na+) = 2c(C2O42-)+c(HC2O4- )
C.V(NaOH) = 10 mL时,溶液的pH为9,则10-9= 10-5-2c(H2C2O4)-c(HC2O4-)
D.V(NaOH)>10 mL时,可能存在c(OH- )>c(Na+)>c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物 A 是一种重要的化工原料,以 A为起始原料可合成药物 I(结构简式如下),其合成路线如下:

已知:①有机物 D 为芳香烃
②RNH2+
![]()
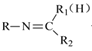 +H2O
+H2O
回答下列问题:
(1)F 的名称是_____,B 中官能团的名称是_____。
(2)由 B→C、E+H→I 的反应类型分别是_____、_____。
(3)G 的结构简式为_____。
(4)D→F 所需的试剂和反应条件是_____。
(5)G 和 CH3CHO 反应生成 H 的化学方程式为_____。
(6)芳香化合物J是 E的同分异构体。若J 能发生银镜反应,则J 可能结构有______种(不含立体异构), 其中核磁共振氢谱有四组峰,且峰面积之比为 1:1:2:6 的结构简式为_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通干电池是一种广泛使用的可移动化学电源。 某同学在探究废酸性干电池内物质回收利用时,进行如图所示实验:
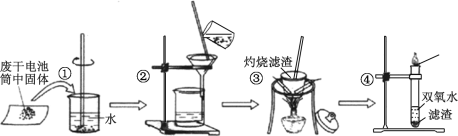
请回答以下问题:
(1)干电池工作时正极电极反应式为:2NH4++2e- = 2NH3↑+H2↑,则负极电极反应式是___________。 电池中加入 MnO2 的作用是除去正极上的某产物, 本身生成Mn2O3,该反应的化学方程式是_______________。
(2)步骤③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、______ 、泥三角和三脚架;灼烧滤渣时,产生一种无色无味能使澄清石灰水变浑浊的气体,由此推测灼烧前的滤渣中存在的物质有_____。
(3)向步骤④的试管中加入步骤③灼烧后所得黑色固体,试管中迅速产生能使带火星的木条复燃的气体,据此可初步认定灼烧后的黑色固体为_____。
(4)查询资料得知,通过电解可将 Mn2O3 转化为 MnO2。 为此某同学设计了如图所示装置,并将混合物粉末调成糊状,附在其中的_________(填“左”或“右”)边电极上,该电极上发生反应的电极反应式是_____, 在电解过程中溶液的 pH 将__________(填“变大”、“变小”或“不变”)。
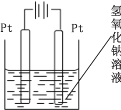
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期包含18种元素,其中多种元素具有重要的用途,在现代工业中备受青睐。
(l)铁位于元素周期表____区,Fe3+的价电子排布式为 ____。
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,可用en代表,其能够与Cu2+形成稳定环状配离子,可表示为[Cu(en)2]2+,其中Cu2+的配位数为____。1 mol[Cu(en)2]C12中含有σ键的数目为____。
(3)气态SeO3为单分子,该分子中Se原子的杂化轨道类型为 ___。用物质结构理论解释H2SeO4比H2SeO3酸性强的原因:______________。
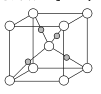
(4)如图为Cu2O的晶胞结构,其中黑球表示____原子(填元素符号);Cu2O的密度为pg·cm-3则晶胞的边长为 ___cm。(用NA表示阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式不正确的是
A.用氨水吸收过量的二氧化硫:![]()
B.向0.5mol L-1 KAl(SO4)2溶液中滴入0.5mol L-1 Ba(OH)2溶液使![]() 恰好完全沉淀:2Ba2+ 4OH- + Al3++2
恰好完全沉淀:2Ba2+ 4OH- + Al3++2![]() =2BaSO4↓+
=2BaSO4↓+![]() +2H2O
+2H2O
C.用足量Na2S2O3溶液除去水中的 Cl2: 4Cl2+![]() +5H2O =10H++2
+5H2O =10H++2![]() +8Cl-
+8Cl-
D.少量CO2通入苯酚钠溶液中:C6H5O-+CO2+H2O→C6H5OH+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液X 中含有下表中离子若干种,且离子浓度均为相等(不考虑水的电离与离子水解)。向X 中加入足量稀盐酸,有无色气体生成, 经分析反应前后阴离子种类没有变化,下列说法正确的是
阳离子 | Na+、Ca2+ 、Fe3+、Fe2+、Al3+、Mg2+ |
阴离子 | OH-、 |
A.溶液X 中可能有![]() 或
或![]() 中的一种或两种都有
中的一种或两种都有
B.溶液X 中是否有Na+不能确定,需通过焰色反应来确定
C.溶液X 中可能有2 种阳离子,3 种阴离子
D.原溶液一定没有Al3+、Fe 3+,但Na+,、![]() 不确定
不确定
查看答案和解析>>
科目:高中化学 来源: 题型:
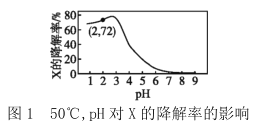
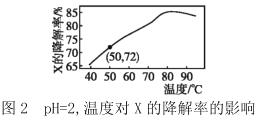
【题目】在10min内,相同浓度的有机污染物X的降解率随pH和温度的关系如图1和图2所示。
下列说法不正确的是( )
A.50℃,pH=4时X降解速率大于pH=5时的降解速率
B.由图1和图2可知,随温度的升高和pH的增大X的降解率不一定增大
C.由图1和图2可判断反应最佳条件:pH=3,温度为80℃
D.若50℃,pH=2时降解速率v(X)=1.44×10-4mol·L-1·min-1,则初始c(X)=2.0×10-3mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如图。下列说法正确的是
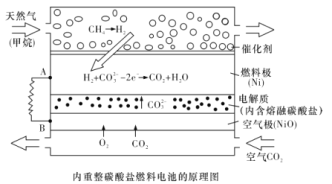
A.以此电池为电源电解饱和食盐水,当有0.2 mol e-转移时,阳极产生2.24 L气体
B.若以甲烷为燃料气时负极电极反应式:CH4+5O2- - 8e - =CO32- +2H2O
C.该电池使用过程中需补充Li2CO3和K2CO3
D.空气极发生的电极反应式为O2+4e- +2CO2 =2CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com