
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.14g由C2H4和N2组成的混合气体中所含质子总数一定为7.5NA
B.1molP4S3( )中所含P—S键的数目为9NA
)中所含P—S键的数目为9NA
C.1L0.1mol·L-1NaHSO3溶液中所含阳离子的总数大于0.1NA
D.11.2LCl2与足量乙烷在光照条件下反应产生HCl分子的总数为0.5NA
科目:高中化学 来源: 题型:
【题目】如下图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器。当其它条件相同时,在Ⅰ、Ⅱ中分别加入2mol![]() 和2mol
和2mol![]() ,开始时容器的体积均为VL,发生如下反应并达到平衡状态
,开始时容器的体积均为VL,发生如下反应并达到平衡状态![]() 提示:物质X,Y的状态均未知,物质Z的状态为气态),2X(?)+Y(?)
提示:物质X,Y的状态均未知,物质Z的状态为气态),2X(?)+Y(?)![]() aZ(g)此时Ⅰ中X,Y,Z的物质的量之比为1:3:2。下列判断正确的是
aZ(g)此时Ⅰ中X,Y,Z的物质的量之比为1:3:2。下列判断正确的是![]()
![]()
Ⅰ Ⅱ
Ⅱ Ⅲ
Ⅲ
A.物质Z的化学计量数 a= 2
B.若X、Y均为气态,则在平衡时X的转化率:Ⅰ<Ⅱ
C.若Ⅱ中气体的密度如图Ⅲ所示,则X、Y中只有一种为气态
D.若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
A. 该溶液的pH=4 B. 升高温度,溶液的pH增大 C. 此酸的电离平衡常数约为1×10-7 D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:N2(g)+O2(g)=2NO(g); △H=+180.5 kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-905 kJ·mol-1
2H2(g)十O2(g)=2HO(g):△H=--483.6 kJ·mol-1
则N2(g)+3H2(g)![]() 2NH3(g)的△H=___________。
2NH3(g)的△H=___________。
(2)在一定条件下,将2mol N2与5mol H2混合于一个10 L的密闭容器中,反应情况如图1所示:
①求5min内的平均反应速率v(NH3)______________;
②达到平衡时NH3的体积分数为______________________。
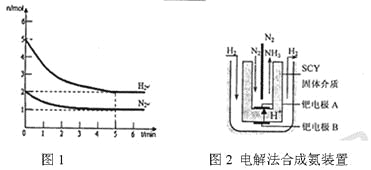
(3)近年来科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多品薄膜做电极,实现了高转化率的电解法合成氨(装置如图2)。钯电极A上发生的电极反应式是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是世界铅生产和铅消费的最大国,而铅的冶炼方法具有成本高、污染严重等缺点。化学沉淀法是除去酸性废水中Pb2+的主要方法,根据其原理不同可以分为氢氧化物沉淀法、硫化物沉淀法、磷酸盐沉淀法、铁氧体沉淀法等。水溶液中各形态铅的百分含量x与溶液pH变化的关系如图所示。向含Pb2+的溶液中逐滴滴加NaOH溶液,溶液变浑浊,继续滴加NaOH溶液又变澄清。
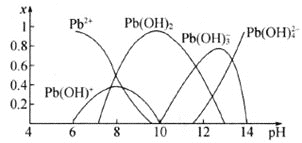
(1)若采用氢氧化物沉淀法除去溶液中的Pb2+,应将溶液的pH调至约为___。pH≥13时,溶液中发生的主要反应的离子方程式为___。
(2)向酸性含铅废水中加Na2S可将Pb2+转化为PbS除去,使用该方法通常先将溶液pH调至6左右,若溶液pH过低会导致___。已知Kap(PbS)=8.0×10-28,国家规定的废水排放标准中铅含量不高于0.5 mgL-1,若某工厂处理过的废水中S2-浓度为2.0×10-20molL-1,该废水中铅含量___(填“已经”或“尚未”)达到国家规定的排放标准。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2与H2反应生成NH3的过程中能量变化曲线如图所示。若在一个固定容积的密闭容器中充入1 mol N2和3 mol H2,使反应N2+3H2![]() 2NH3达到平衡,测得反应放出热量为Q1。
2NH3达到平衡,测得反应放出热量为Q1。
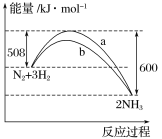
(1)该反应的热化学方程式为__________________________。
(2)Q1________92 kJ(填“>”“<”或“=”)。
(3)曲线a和曲线b中,加了催化剂的是________。
(4)上述反应达到平衡后,升高温度H2的转化率________(填“增大”“不变”或“减小”)。
(5)在温度体积一定的条件下,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则2Q1与Q2的关系为: Q2 ______2Q1(“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)HClO的电离方程式为__________________________。
(2)用离子方程式解释铁盐可用于净水的原理__________________________。
(3)在NaOH 溶液中逐渐加入稀醋酸至溶液呈中性,则所得溶液中c(Na+)_______c(CH3COO-)(填“>”“<”或“=”下同)。
(4)相同pH的NH4Cl溶液与NH4HSO4溶液中NH4+浓度的大小关系:前者_______后者。
(5)用惰性电极电解500mL某浓度的CuSO4溶液一段时间后,CuSO4刚好反应完,需要加入16gCuO才能复原,则原CuSO4溶液的物质量浓度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y 各0.16 mol充入10 L 恒容密闭容器中,发生反应
X(g) + Y(g) ![]() 2Z(g) H<0,一段时间后达到平衡,反应过程中测定的数据如下表。下列说法正确的是
2Z(g) H<0,一段时间后达到平衡,反应过程中测定的数据如下表。下列说法正确的是
t / min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前2min的平均速率v(Z)=2.0×10–5 mol/(L·min)
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行反应:2SO2(g)+O2(g) ![]() 2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.4mol/L、0.2mol/L、0.4mol/L,当反应达平衡时,可能存在的数据是
2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.4mol/L、0.2mol/L、0.4mol/L,当反应达平衡时,可能存在的数据是
A. SO2为0.8mol/L,O2为0.4mol/L
B. SO2为0.5mol/L
C. SO3为0.8mol/L
D. SO2、SO3一定均为0.3mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com