
Ⅰ.二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用下图所示装置模拟工业制取并收集ClO2。

(1)A必须添加温度控制装置,除酒精灯、温度计外,还需要的玻璃仪器有 ???????? 。
(2)反应后在装置C中可得NaClO2溶液。已知在温度低于38℃时NaClO2饱和溶液中析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据上右图所示的NaClO2的溶解度曲线,请补充从NaClO2溶液中制得NaClO2晶体的操作步骤: ① 蒸发结晶;② ??????????? ;③ 洗涤;④ 干燥。
(3)ClO2很不稳定,需随用随制,用水吸收得到ClO2溶液。为测定所得溶液中ClO2的浓度,进行了下列实验:① 准确量取ClO2溶液V1mL加入到锥形瓶中,加适量蒸馏水稀释,调节试样的pH≤2.0。② 加入足量的KI晶体,静置片刻。此时发生反应的离子方程式为:????????????? ;③ 加入淀粉指示剂,用c mol/L Na2S2O3溶液滴定,至终点时消耗Na2S2O3溶液V2 mL。则原ClO2溶液的浓度为????????? mol/L(用含字母的代数式表示)。(已知2 Na2S2O3+I2= Na2S4O6+2NaI)
Ⅱ.将由Na+、Ba2+、Cu2+、SO42-、Cl- 组合形成的三种强电解质溶液,分别装入下图装置
中的甲、乙、丙三个烧杯中进行电解,电极均为石墨电极。

接通电源,经过一段时间后,测得乙中c电极质量增加。常温下各烧杯中溶液pH与电解时间t的关系如右上图(忽略因气体溶解带来的影响)。据此回答下列问题:
(1)写出乙烧杯中发生反应的化学方程式?????????????????????????????????????? ;
(2)电极f上发生的电极反应为????????????????????????????? ;
(3)若经过一段时间后,测得乙烧杯中c电极质量增加了8g,要使丙烧杯中溶液恢复到原来的状态,应进行的操作是??????????????????????????????????? 。
I. (1)? 烧杯?? (2分)?? (2) 趁热过滤?? (2 分)
(3)2ClO2 + 8H+ + 10I-===2 Cl— + 5I2? + 4H2O??? (3 分)?????????? 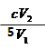 (2 分)
(2 分)
Ⅱ.(1)2CuSO4 + 2H2O  2Cu + O2↑ + 2H2SO4(2分)??
2Cu + O2↑ + 2H2SO4(2分)??
(2)4OH--4e-=2H2O + O2↑(2分)
(3)向丙烧杯中加入2.25g水(3分)
【解析】
试题分析:Ⅰ.(1)本题要结合题干所给信息解答。题干中提到制备二氧化氯是由潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得的,因此暗示该反应需要控制反应温度。控制该反应温度在60℃,可以选择60℃的热水浴。因此热水浴的温度控制装置除酒精灯、温度计外,还需要的玻璃仪器应该是能装水浴加热用的大烧杯。
(2)题中已说明NaClO2溶液容易得到2中晶体,而低于38℃时NaClO2饱和溶液中析出晶体是NaClO2·3H2O,高于38℃时析出晶体是NaClO2 ,因此要得到无结晶水的NaClO2 晶体,要保证在过滤的时候温度高于38℃,因此采用趁热过滤。
(3)酸化的ClO2溶液中加入KI晶体后,溶液变蓝,说明有碘单质生成,所以发生的氧化还原反应离子方程式为2ClO2 + 8H+ + 10I-===2 Cl— + 5I2? + 4H2O。
根据已知反应方程式关系得:n(ClO2)=2/5 n(I2) , n(I2)=1/2 n(Na2S2O3),因此n(ClO2)=1/5 n(Na2S2O3)。所以c (ClO2 )= 1/5×c×V2 ÷V1 =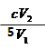 mol/L
mol/L
Ⅱ.从常温下各烧杯中溶液pH与电解时间t的关系图可知,甲、丙两烧杯起始pH值等于7,甲、丙的电解质溶液是强酸强碱盐;乙烧杯起始pH值小于7,电解质溶液为强酸弱碱盐。乙烧杯的电极C质量增重,则可推断增重原因为有金属Cu析出,该电极是阴极,并由此可以得出电源M为负极,N为正极;a、c、e为阴极,b、d、f为阳极。
(1)乙烧杯的电极C质量增重,阴极为Cu2+放电;溶液pH值逐渐降低,说明溶液中阳极OH-放电,使溶液中氢离子增多;所以根据放电情况可以推测得出乙中的电解质溶液为CuSO4溶液,因此电解该溶液的化学方程式为2CuSO4 + 2H2O  2Cu + O2↑ + 2H2SO4 。
2Cu + O2↑ + 2H2SO4 。
(2)丙烧杯中的电解质是强酸强碱盐,随着电解的进行,丙中的溶液pH值不变,则阴极e为H+放电,阳极f上OH-放电,电解实质在电解水,由此可推测该电解质溶液是Na2SO4,因此f电极反应式为4OH--4e-=2H2O + O2↑。
(3)乙烧杯中c电极质量增加了8g,则生成了0.125mol的单质Cu,则转移电子0.25mol,因此丙烧杯中电解消耗0.125mol的水,要使溶液恢复,应该加入0.125mol的水,即2.25g水。
考点:本题考查的是实验仪器和实验操作、电化学基础知识。


科目:高中化学 来源: 题型:阅读理解
 氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:
氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究小组用黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2气体,再用水吸收该气体可得ClO2溶液.在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成
某研究小组用黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2气体,再用水吸收该气体可得ClO2溶液.在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成- 3 |
2- 4 |
2- 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012届浙江省台州市四校高三第一次联考化学试卷 题型:填空题
(8分)I、二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。比Cl更好。
⑴在ClO2的制备方法中,有下列两种制备方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O[来源:学+科+网]
用方法二制备的ClO2更适合用于饮用水消毒,其主要原因是 。
⑵用ClO2处理过的饮用水(pH 5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2—)。
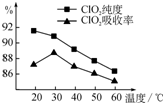
饮用水中的ClO2、ClO2—含量可用连续碘量法进行测定。ClO2被I—还原为ClO2—、Cl—的转化
率与溶液pH的关系如下图所示。当pH≤2 .0时,ClO2—也能被I—完全还原为Cl—。反应生成
的I2用标准Na2S2O3溶液滴定;2Na2S2O3+ I2= Na2S4O6 + 2NaI
①请写出pH≤2 .0时ClO2—与I—反应的离子方程式 。
②请完成相应的实验步骤:
步骤1:准确量取V mL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的KI晶体。
步骤4:加入少量淀粉溶液,用c mol·L-1Na2S2O3
溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤5: 。
步骤6:再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
③根据上述分析数据,测得该饮用水中ClO2—的浓度为 mol·L-1(用含字母的代数式表示)。
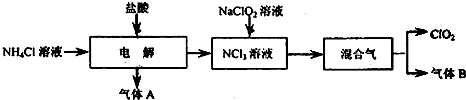
II.(11分)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。已知高铁酸盐热稳定性差 ,工业上用湿法制备高铁酸钾的基本流程如下图所示:
,工业上用湿法制备高铁酸钾的基本流程如下图所示:
⑴在农业生产中,滤液1可用作 。
⑵流程中生成高铁酸钾的离子方程式是: ,控制此反应温度30℃以下的原因是:  。
。
⑶结晶过程中加入浓KOH溶液的作用是: 。[来源:学_科_网]
⑷某温度下,将Cl2通入KOH溶液中,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-离子的物质的量之比是2:3,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为 。
⑸实验测得铁盐溶液的质量分数、反应时间与K2FeO4产率的实验数据分别如图1、图2所示。为了获取更多的高铁酸钾,铁盐的质量分数应控制在 附近、反应时间应控制在 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com