
【题目】钢铁厂在冷轧过程中会产生高浓度酸性含铁废水,主要含有H+、Cl﹣、Fe2+、Fe3+等,其处理的主要工艺流程如下:
请回答:
(1)废水未经处理直接排放的危害是(填字母).
a腐蚀水利设施 b影响水生生物的自然生长
(2)石灰乳用于中和含铁废水中的酸,写出石灰乳与盐酸反应的化学方程式: .
(3)过氧化氧的主要作用是(填字母).a还原剂 b氧化剂
(4)自来水厂常用漂白粉、液氯、二氧化氯、臭氧等作为消毒剂,杀灭水中的细菌.液氯注入水中后,能杀死水中细菌的物质是(填化学式).
(5)污水处理中的主要化学方法有中和法、、、 .
(6)某研究小组对钢铁厂高浓度酸性含铁废水进行监测时,取其样本稀释,测得有关数据如下:
离子 | H+ | Cl﹣ | Fe2+ | Fe3+ |
浓度(molL)﹣1 | 0.16 | 0.94 | 0.18 |
稀释后的溶液中c(Fe2+)=mol/L.
【答案】
(1)ab
(2)Ca(OH)2+2HCl═CaCl2+2H2O
(3)b
(4)HClO
(5)混凝法;沉淀法;氧化还原法
(6)0.12.
【解析】(1)因为废水中含有H+、Cl﹣、Fe2+、Fe3+等,其中氢离子成酸性会腐蚀水利设施,Fe3+具有强氧化性会影响水生生物的自然生长,故选:ab;
(2)石灰乳与盐酸反应生成氯化钙、水和二氧化碳,方程式为:Ca(OH)2+2HCl═CaCl2+2H2O,
(3)过氧化氢具有强氧化性,主要作用氧化剂,故选:b;
(4)氯气与水反应生成具有强氧化性的HClO,可用于杀菌消毒,能杀死水中细菌,故答案为:HClO;
(5)水处理中的主要化学方法有中和法、混凝法、沉淀法、氧化还原法等;
(6)根据溶液中电荷守恒得,c(Fe2+)= ![]() =0.12mol/L,
=0.12mol/L,
(1)根据废水中的主要成分判断危害;
(2)石灰乳是碱,与盐酸发生中和反应;
(3)根据过氧化氢的氧化性进行分析;
(4)氯气与水反应生成的次氯酸具有杀菌消毒作用;
(5)根据水的处理方法进行分析即可;
(6)根据溶液中电荷守恒进行计算亚铁离子的物质的量浓度。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L。
![]()
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶
液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是_________(写离子符号)。
(2)Ⅲ中加入少量盐酸生成无色气体的的离子方程式是__________________。
(3)将Ⅲ中所得红棕色气体通入水中,气体变无色,所发生的化学方程式为______________。
(4)甲同学最终确定原溶液中所含阳离子是__________,阴离子是_________(写离子符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.溶液能透过半透膜,而胶体和浊液均不能
B.胶体和其它分散系的本质区别是分散质粒子的大小
C.硫酸钡几乎不溶于水,所以它是非电解质
D.CO2溶于水能导电,但是它却是非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一容积为2升的密闭容器内加入0.2mol的N2和0.6mol 的H2 , 在一定条件下发生如下反应:N2(g)+3H2(g)2NH3(g)+Q(Q>0).反应中NH3的物质的量浓度的变化的情况如右图:
(1)根据下图,计算从反应开始到平衡时,平均反应速率v(NH3)为 . 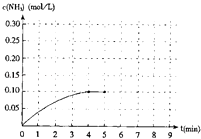
(2)该反应的化学平衡常数表达式为 .
(3)反应达到平衡后,第5分钟时,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为 .
A、0.20mol/L B、0.16mol/L C、0.10mol/L D、0.05mol/L
(4)反应达到平衡后,第5分钟时,保持其它条件不变,若只把容器的体积缩小一半,平衡移动(填“向左”、“向右”或“不”),化学平衡常数K填“增大”、“减小”或“不变”).
(5)第5分钟把容器的体积缩小一半后,若在第8分钟达到新的平衡(此时NH3的浓度约为0.25mol/L),请在上图中画出第5分钟到此平衡时NH3浓度的变化曲线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得AlCl3为共价化合物,两个Al—Cl键间的夹角为120°。由此可见,AlCl3属于 ( )
A. 由极性键形成的极性分子
B. 由极性键形成的非极性分子
C. 由非极性键形成的极性分子
D. 由非极性键形成的非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
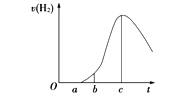
【题目】I.把在空气中久置的铝片5.0 g投入盛有500 mL 0.5 mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用下图所示的坐标曲线来表示。
请回答下列问题。
(1)曲线由O→a段不产生氢气的原因是____________________。
有关反应的化学方程式为_________________________。
(2)曲线由a→c段,产生氢气的速率增加较快的主要原因是_______________________________。
(3)曲线由c以后产生氢气的速率逐渐下降的主要原因是_______________________________。
II.某同学在用稀硫酸与锌反应制取氢气的实验中,发现加入少量硫酸铜溶液可以加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有:______________、_________________;
(2) 硫酸铜溶液可以加快氢气生成速率的原因:__________________;
(3) 实验中现有Na2SO4、MgSO4、 Ag2SO4、 K2SO4四种溶液,可与上述实验中CuSO4溶液起相似作用的是:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关甲烷和乙烷的说法中,错误的是
A.互为同系物
B.均不能使高锰酸钾酸性溶液褪色
C.在核磁共振氢谱图(1H核磁共振谱图)中,均只有1个吸收峰
D.二氯取代物均为两种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com