
【题目】已知侯氏制碱法的主要反应为NaCl + NH3 + CO2 + H2O = NaHCO3↓ + NH4Cl。某实验小组模拟工业生产制备少量NaHCO3,将实验流程分为制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤。下列图示装置和操作能达到实验目的的是
A. 制取氨气B.
制取氨气B. 制取NaHCO3
制取NaHCO3
C. 分离NaHCO3D.
分离NaHCO3D. 干燥NaHCO3
干燥NaHCO3
科目:高中化学 来源: 题型:
【题目】已知:如图中A是金属铁,请根据图中所示的转化关系,回答下列问题:
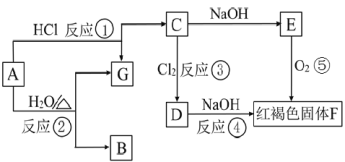
(1)写出下列物质对应的化学式B _______________、E ________________;
(2)写出对应反应的化学方程式:
②________________________;
③_________________________ ;
⑤________________________ ;
(3)写出对应在溶液中反应的离子方程式:④ ____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为 ___________________。
②下列方法中,可以使醋酸稀溶液中 CH3COOH 电离程度增大的是 __________________(填字母序号)。
a 滴加少量浓盐酸 b 微热溶液 c 加水稀释 d 加入少量醋酸钠晶体
(2)用 0.1 mol·L-1NaOH 溶液分别滴定体积均为 20.00 mL、浓度均为 0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液 pH随加入 NaOH溶液体积而变化的两条滴定曲线。
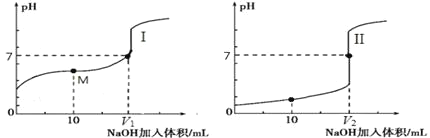
①滴定醋酸的曲线是_______________(填“I”或“II”)。
②室温时,若 0.1 mol·L-1的醋酸的电离度为 1%,计算这醋酸溶液的 pH 值________。
③滴定开始前,三种溶液中由水电离出的 c(H+)最大的是________________。
④上述用 0.1 mol·L-1的 NaOH 溶液滴定 0.1 mol·L-1的盐酸,下列操作不正确的是________________。
A.用标准 NaOH 溶液润洗碱式滴定管后,再装入标准碱溶液
B.用待测酸溶液润洗锥形瓶后,再装入待测酸溶液
C.滴定时两眼应注视滴定管中液面的变化,以免滴定过量
D.读数时,视线应与滴定管凹液面的最低点保持水平
⑤上述滴定用酚酞作指示剂,滴定终点的现象_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国是世界上最大的钨储藏国,超细钨粉是生产硬质合金所必须的原料。
(1)工业上可以采用铝热还原法生产钨铁合金,已知:
①WO3(s)+2Al(s)=W(s)+Al2O3(s) H1
②3Fe3O4(s)+8Al(s)=9Fe(s)+4Al2O3(s) H2
则四氧化三铁与钨反应的热化学方程式为___(反应热写为H3并用含△H1、AH2的代数式表示);在反应②中若有0.1molFe3O4参加反应,则转移电子___mol。
(2)自然界中钨主要存在于黑钨矿中(主要成分是铁和锰的钨酸盐),从中制备出黄钨(WO3)后再用H2逐级还原:WO3→WO2.90→WO2.72→WO2→W,总反应为3H2(g)+WO3(s)![]() W(s)+3H2O(g) H,实验测得一定条件下平衡时H2的体积分数曲线如图所示:
W(s)+3H2O(g) H,实验测得一定条件下平衡时H2的体积分数曲线如图所示:
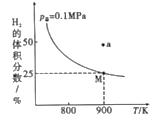
①由图可知,该反应的H____(填“>”或“<”)0;a点处的v正___v逆(填“>”“<”或“=”)。
②如果上述反应在体积不变的密闭容器中达到平衡,下列说法错误的是__(填序号)。
A.v正(H2)=v逆(H2O)
B.加入WO3,则H2的转化率增大
C.容器内气体的密度不变时,一定达到平衡状态
D.容器内压强不变时,一定达到平衡状态
③由图可知900K,氢气的平衡转化率为__,Kp(900K)=____(用平衡分压代替平衡浓度计算,已知:平衡分压=p总×气体物质的量分数)。
④已知在高温下,氧化钨会与水蒸气反应生成一种挥发性极强的水钨化合物WO2(OH)2,因此在反应中要适当加快氢气的流速,原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标准生成热指的是在某温度下,由处于标准状态的各种元素的最稳定的单质生成标准状态下 1mol 某纯物质的热效应,单位常用 kJ/mol表示,已知在 25℃的条件下:
①Ag2O(s)+2HCl(g)═2AgCl(s)+H2O(l)△H=-324.4 kJ/mol
②2Ag(s)+ ![]() O2(g)═Ag2O(s)△H=-30.56kJ/mol
O2(g)═Ag2O(s)△H=-30.56kJ/mol
③ ![]() H2(g)+
H2(g)+ ![]() Cl2(g)═HCl(g)△H=-92.21 kJ/mol
Cl2(g)═HCl(g)△H=-92.21 kJ/mol
④H2(g)+ ![]() O2(g)═H2O(l)△H=-285.6 kJ/mol
O2(g)═H2O(l)△H=-285.6 kJ/mol
则25℃时氯化银的标准生成热为________ kJ/mol;
(2)实验测得 64g 甲醇[CH3OH(l)]在氧气中充分燃烧生成 CO2 气体和液态水时放出 1452.8kJ 的热量,则表示甲醇燃烧热的热化学方程式_________________;
(3)以甲烷、氧气为原料,KOH 为电解质,构成燃料电池,写出其负极的电极反应式:________;
(4)电解法制取有广泛用途的 Na2FeO4,工作原理如下图所示。
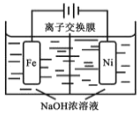
已知:Na2FeO4 只在强碱性条件下稳定。
①Na2FeO4能够净水的主要原因是_______________ 。
②阳极电极反应式 _______________;
③为使电解能较持久进行,应选用_______________ 离子交换膜(填“阴”或“阳”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增加。A是元素Y的单质。常温下,A遇甲的浓溶液发生钝化。丙、丁、戊是由这些元素组成的二元化合物,且丙是无色气体,上述物质的转化关系如下图所示,下列说法正确的是
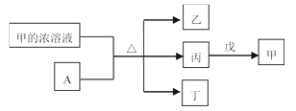
A.由于丁和戊化学键相同,所以它们都是平面结构
B.简单氢化物的沸点: X>Z
C.简单离子半径大小: X<Y
D.Y的简单离子与Z的简单离子在水溶液中可大量共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.乙酸和甲醛分别完全燃烧,若消耗的氧气量一样,则它们的质量相等
B.通过核磁共振氢谱可以区分CH3 CH2CH2OH和![]()
C.莽草酸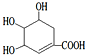 可以发生氧化、还原、酯化、加聚反应
可以发生氧化、还原、酯化、加聚反应
D.Cl2与甲苯在光照条件下反应,苯环上的氢原子被取代
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:①C(s)+O2(g)=CO2(g)△H1;
②C(s)+![]() O2(s)=CO(g)△H2;
O2(s)=CO(g)△H2;
③CO2(g)+C(s)=2CO(g)△H3;
④4Fe(s)+3O2(g)=2Fe2O3(s)△H4;
⑤3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)△H5
下列判断正确的是( )
A.△H4是Fe的燃烧热
B.△H1>△H2
C.△H3=2△H2-△H1
D.3△H1-3△H2-![]() △H4+△H5=0
△H4+△H5=0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸(如图),存在于许多中药,如野胡萝卜、光叶水苏、荞麦等中。咖啡酸有止血作用。下列关于咖啡酸的说法不正确的是
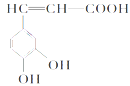
A.咖啡酸的分子式为C9H8O4
B.1 mol咖啡酸可以和含4 molBr2的浓溴水反应
C.1 mol咖啡酸与足量NaHCO3溶液反应能产生标况下约67.2L的CO2
D.不可以用高锰酸钾检验咖啡酸分子中的碳碳双键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com