
【题目】高纯镍常用作加成反应的催化剂,制取原理:Ni(s)+4CO(g)![]() Ni(CO)4(g),实验室用如图所示装置制取Ni(CO)4,已知CO+PdCl2+H2O=CO2+Pd↓(黑色)+2HCl;Ni(CO)4熔点-25℃,沸点43℃,60℃以上与空气混合易爆炸:Fc(CO)5熔点-20℃,沸点103℃。回答下列问题:
Ni(CO)4(g),实验室用如图所示装置制取Ni(CO)4,已知CO+PdCl2+H2O=CO2+Pd↓(黑色)+2HCl;Ni(CO)4熔点-25℃,沸点43℃,60℃以上与空气混合易爆炸:Fc(CO)5熔点-20℃,沸点103℃。回答下列问题:
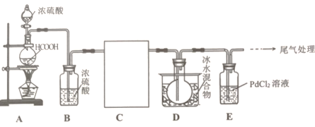
(1)装置A中发生反应的化学方程式为__________________。
(2)装置C用于合成Ni(CO)4(夹持装置略),最适宜选用的装置为__________________(填标号).
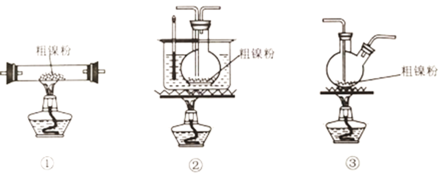
(3)实验过程中,必须先观察到__________________(填实验现象)才加热C装置,原因是__________________。
(4)制得的Ni(CO)4中常溶有Fe(CO)5等杂质,提纯的方法是__________________(填标号).
A.分液 B.过滤 C.蒸馏 D.蒸发浓缩、冷却结晶
(5)利用“封管实验“原理也可冶炼高纯镍。如图所示的石英玻璃封管中充有CO气体,则不纯的镍(Ni)粉应放置在封管的__________________温度区域端(填“323K”、“473K”)

(6)实验中加入6.90gHCOOH,C装置质量减轻1.18g(设杂质不参加反应,)E装置中盛有PdCl2溶液200mL.则PdCl2溶液的物质的量浓度至少为__________________molL-1。
【答案】HCOOH![]() H2O+CO↑ ② E装置中产生黑色沉淀 防止CO及Ni(CO)4与装置中空气混合在加热条件下爆炸 C 323K 0.35
H2O+CO↑ ② E装置中产生黑色沉淀 防止CO及Ni(CO)4与装置中空气混合在加热条件下爆炸 C 323K 0.35
【解析】
利用HCOOH和浓硫酸制备CO,装置B中的浓硫酸用于干燥,由于Ni和CO在50~80℃发生反应生成Ni(CO)4,采用水浴加热的方式,Ni(CO)4的沸点较低,得到是气体,通过冷凝的方法在装置D中收集得到产品,最后利用PdCl2检验CO。
(1)装置A中甲酸与在浓硫酸的作用下生成CO和水,反应方程式为HCOOH![]() H2O+CO↑;
H2O+CO↑;
(2)温度在5080℃是更有利于Ni(CO)4的生成,为了更好的控制温度,且可避免温度过高,可选用水浴加热,所以选用②装置;
(3)CO及Ni(CO)4与装置中空气混合在加热条件下会发生爆炸,所以要先观察到E装置中生成黑色沉淀,再加热C装置;
(4)Ni(CO)4沸点43℃,Fe(CO)5沸点103℃,可采用蒸馏的方法进行提纯,故选C;
(5)323K是49.85℃,73K是199.85℃,根据方程式Ni(s)+4CO(g)![]() Ni(CO)4(g),可知180200℃时生成Ni单质,所以高纯镍粉在封管的473K温度区域端生成,不纯的镍粉在封管的323K温度区域端反应;
Ni(CO)4(g),可知180200℃时生成Ni单质,所以高纯镍粉在封管的473K温度区域端生成,不纯的镍粉在封管的323K温度区域端反应;
(6)n(HCOOH)=![]() ,则生成的n(CO)=0.15mol,C装置中发生Ni(s)+4CO(g)
,则生成的n(CO)=0.15mol,C装置中发生Ni(s)+4CO(g)![]() Ni(CO)4(g),则C管减轻的质量即反应的Ni的质量,则反应n(Ni)=
Ni(CO)4(g),则C管减轻的质量即反应的Ni的质量,则反应n(Ni)=![]() ,则消耗n(CO)=0.08mol,所以PdCl2溶液至少要吸收CO的物质的量为0.15mol0.08mol=0.07mol,根据方程式CO+PdCl2+H2O=CO2+Pd↓(黑色)+2HCl可知所需n(PdCl2)=0.07mol,所以其浓度至少为
,则消耗n(CO)=0.08mol,所以PdCl2溶液至少要吸收CO的物质的量为0.15mol0.08mol=0.07mol,根据方程式CO+PdCl2+H2O=CO2+Pd↓(黑色)+2HCl可知所需n(PdCl2)=0.07mol,所以其浓度至少为![]() 。
。


科目:高中化学 来源: 题型:
【题目】某温度时在2L容器中X、Y、Z三种物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据
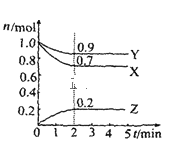
(1)该反应的化学方程式为:______。
(2)反应开始至2min,用Z表示的平均反应速率为:______。
(3)下列叙述能说明上述反应达到化学平衡状态的是______(填序号):
A.混合气体的总物质的量不随时间的变化而变化
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗3molX,同时生成2molZ
D.混合气体的总质量不随时间的变化而变化
(4)在密闭容器里,通入amolX(g)和bmolY(g),发生反应X(g)+Y(g)═2Z(g),当改变下列条件时,反应速率会发生什么变化(选填“增大”、“减小”或“不变”)?
①降低温度:_____ ②恒容通入氦气:_____③使用催化剂:______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把Na2CO3和NaHCO3的混合物27.4g加热到质量不再变化时,得残留固体21.2g。求原混合物中NaHCO3和Na2CO3的质量之比为( )
A.53∶84B.1∶1C.84∶53D.42∶53
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2A(g)+B(g)![]() 2C(g)+2D(g) 在4种不同情况下反应速率分别如下,其中反应速率v最大的是
2C(g)+2D(g) 在4种不同情况下反应速率分别如下,其中反应速率v最大的是
A. v(A)=0.15mol·(L·min) -1B. v (B)=0.2 mol·(L·min) -1
C. v (C)=0.3 mol·(L·min) -1D. v (D)=0.1 mol·(L·min) -1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定HCl、H2CO3、H2SiO3的酸性强弱,某同学设计了如图所示的装置,下列有关叙述正确的是( )
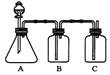
A.HCl、H2CO3、H2SiO3的酸性依次增强
B.A中锥形瓶中生成CO2气体
C.B中装饱和Na2CO3溶液,用于除去A中挥发出的HCl气体
D.C中装Na2SiO3溶液,预期现象是先出现白色沉淀后又逐渐溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)SO2在烟尘的催化下形成硫酸的反应方程式是_____。
(2)NOx和SO2在空气中存在下列平衡:
2NO(g)+O2(g)![]() 2NO2(g) △H=-113.0kJmol-1
2NO2(g) △H=-113.0kJmol-1
2SO2(g)+O2(g)![]() 2SO3(g) △H=-196.6kJmol-1
2SO3(g) △H=-196.6kJmol-1
SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3。
①写出NO2和SO2反应的热化学方程式为_____。
②随温度升高,该反应化学平衡常数变化趋势是____。
(3)提高2SO2+O2![]() 2SO3反应中SO2的转化率,是减少SO2排放的有效措施。
2SO3反应中SO2的转化率,是减少SO2排放的有效措施。
①T温度时,在1L的密闭容器中加入2.0molSO2和1.0molO2,5min后反应达到平衡,二氧化硫的转化率为50%,该反应的平衡常数是___。
②在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是____(填字母)。
a.温度和容器体积不变,充入1.0molHe
b.温度和容器体积不变,充入1.0molO2
c.在其他条件不变时,减少容器的体积
d.在其他条件不变时,改用高效催化剂
e.在其他条件不变时,升高体系温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应的叙述正确的是( )
A.SO2与Ba(NO3)2反应生成BaSO3
B.NH3在纯O2中燃烧生成NO2
C.过量CO2与氨水反应生成NH4HCO3
D.高温条件下Fe与水蒸气反应生成Fe(OH)3和H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增加的前四周期的主族元素A~H,有关性质如下:
元素代号 | A | B | C | D | E | F | G | H |
原子半径/nm | 0.037 | 0.074 | 0.073 | 0.071 | 0.143 | 0.102 | 0.099 | 0.114 |
主要化合价 | +1 | +5、-3 | -2 | -1 | +4、-4 | +6、-2 | +7、-1 | +7、-1 |
已知E的单质是一种常见的半导体材料,分析表中数据,用相应的化学式回答有关问题:
(1)元素A与C的原子个数比为1:1的化合物的电子式为_______。
(2)元素B、C、D的第一电离能由大到小的顺序为_______
(3)元素C、F形成的阴离子FC32-空间构型为_______
(4)元素G、H的气态氢化物的稳定性由强到弱顺序为________
(5)元素C、F的气态氢化物沸点由高到低的顺序为______,原因是______
(6)元素E的氢化物(EH4)属于_______分子(填“极性”或“非极性”)
(7)铬的基态原子价电子排布式为______。
(8)尿素[H2NCONH2]分子中,C原子的杂化方式为____;1mol尿素分子中,σ键的数目为______。
(9)带有六个结晶水三氯化铁,是橘黄色的晶体,其化学式为[Fe(H2O)6]Cl3,该化合物中,与Fe3+形成配位键的原子是______,写出H2O的一种阴离子的等电子体______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置进行实验,将液体a逐滴加到固体b中,下列叙述正确的是
选项 | a | b | c | 现象 | 装置图 |
A | 浓H2SO4 | Cu | 澄清石灰水 | c中溶液变浑浊 |
|
B | 浓盐酸 | KMnO4晶体 | 紫色石蕊溶液 | c中溶液最终呈红色 | |
C | 稀HNO3 | Fe | NaOH溶液 | d中红棕色气体变浅 | |
D | 浓氨水 | 生石灰 | Al2(SO4)3溶液 | c中产生沉淀后溶解 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com