
【题目】2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸。发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云。根据掌握的信息分析,装箱区的危险化学品可能有钾、钠、氯酸钠、硝酸钾、烧碱,硫化碱、硅化钙、三氯乙烯、氯碘酸等。运抵区的危险化学品可能有环己胺、二甲基二硫、甲酸、硝酸铵、氰化钠、4,6-二硝基苯-邻仲丁基苯酚等。
回答下列问题:
(1)在组成NH4NO3、NaCN两种物质的元素中第一电离能最大的是__________(填元素符号),解释原因_____________________________________________
(2)二甲基二硫和甲酸中,在水中溶解度较大的是 (填名称),原因是_______;烧碱所属的晶体类型为______;硫化碱(Na2S)的S2-的基态电子排布式是____________。
(3)硝酸铵中,NO3-的立体构型为 ,中心原子的杂化轨道类型为__________
(4)1mol化合物NaCN中CN-所含的π键数为______,与CN-互为等电子体的分子有 。(CN)2又称为拟卤素,实验室可以用氰化钠、二氧化锰和浓硫酸在加热条件下制得,写成该制备的化学方程式___________。
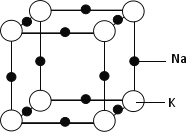
(5)钠钾合金属于金属晶体,其某种合金的晶胞结构如图所示。合金的化学式为____________;晶胞中K 原子的配位数为 ;已知金属原子半径r(Na)=186pm、r(K)=227pm,计算晶体的空间利用率 ________(列出计算式,不需要计算出结果)。
【答案】(1)N;同周期元素第一电离能自左而右呈增大趋势,同主族自上而下元素第一电离能逐渐减小,但N原子的2p能级为半满稳定状态,第一电离能高于氧元素,故第一电离能最大的是N元素
(2)甲酸;甲酸与水形成氢键,而二甲基二硫与水分子间只有范德华力;离子晶体;1s2s22p63s23p6
(3)平面三角形;sp2
(4)2NA;CO或N2;2NaCN+MnO2+2H2SO4(浓)![]() (CN)2+Na2SO4+MnSO4+2H2O
(CN)2+Na2SO4+MnSO4+2H2O
(5)KNa3(或Na3K);6;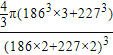 ×100%(或其他合理答案均可)
×100%(或其他合理答案均可)
【解析】
试题分析:(1)同周期元素第一电离能自左而右呈增大趋势,同主族自上而下元素第一电离能逐渐减小,但N原子的2p能级为半满稳定状态,第一电离能高于氧元素的,故NH4NO3、NaCN两种物质的元素中第一电离能最大的是N。
故答案为:N;同周期元素第一电离能自左而右呈增大趋势,同主族自上而下元素第一电离能逐渐减小,但N原子的2p能级为半满稳定状态,第一电离能高于氧元素,故第一电离能最大的是N元素;
(2)甲酸与水形成氢键,而二甲基二硫不能,二甲基二硫与水分子间只有范德华力,故二甲基二硫和甲酸中溶解度较大的是甲酸;烧碱由钠离子和氢氧根构成,所以烧碱是离子晶体,S2-离子核外有18个电子,其基态电子排布式为1s2s22p63s23p6。
故答案为:甲酸;甲酸与水形成氢键,而二甲基二硫与水分子间只有范德华力;离子晶体;1s2s22p63s23p6;
(3)NO3-离子中氮原子的孤电子对数=![]() =0,价层电子对数=3+0=3,所以NO3-立体构型为平面三角形,中心原子氮原子的杂化轨道类型sp2。
=0,价层电子对数=3+0=3,所以NO3-立体构型为平面三角形,中心原子氮原子的杂化轨道类型sp2。
故答案为:平面三角形;sp2;
(4)原子序数相等、价电子总数也相等的微粒互为电子,CN-与N2互为等电子体,二者结构相似,CN-中含有C≡N三键,三键中含有1个σ键、2个π键数,所以1mol化合物NaCN中CN-所含的π键数为2NA,CN-中含有两个原子、10个价电子,与CN-互为等电子体的分子有CO、N2,
根据制取氯气的反应可知,氰化钠、二氧化锰和浓硫酸在加热条件下制得(CN)2,反应化学方程式为:2NaCN+MnO2+2H2SO4(浓)![]() (CN)2+Na2SO4+MnSO4+2H2O。
(CN)2+Na2SO4+MnSO4+2H2O。
故答案为:2NA;CO或N2;2NaCN+MnO2+2H2SO4(浓)![]() (CN)2+Na2SO4+MnSO4+2H2O;
(CN)2+Na2SO4+MnSO4+2H2O;
(5)晶胞中,钠原子数为12×![]() =3,钾原子数为8×
=3,钾原子数为8×![]() =1,所以合金的化学式为KNa3,
=1,所以合金的化学式为KNa3,
根据晶胞图可知,每个K 原子周围有6个钠原子,所以晶胞中K 原子的配位数为6,
晶胞中钠原子和钾原子体积之和为![]() π[(186pm)3×3+(227pm)3],晶胞的边长为钠原子和钾原子的直径之和为2×(186pm+227pm),所以晶胞的体积为(2×186pm+2×227pm)3,晶体的空间利用率为
π[(186pm)3×3+(227pm)3],晶胞的边长为钠原子和钾原子的直径之和为2×(186pm+227pm),所以晶胞的体积为(2×186pm+2×227pm)3,晶体的空间利用率为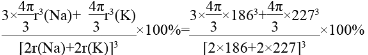 =
=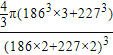 ×100%。
×100%。
故答案为:KNa3(或Na3K);6;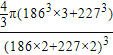 ×100%(或其他合理答案均可)。
×100%(或其他合理答案均可)。


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案科目:高中化学 来源: 题型:
【题目】Y(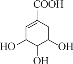 )是由中草药五倍子制备而成。
)是由中草药五倍子制备而成。
(1) Y属于_____填“无机化合物”或“有机化合物”)。
(2) Y中含氧官能团有羧基和_____(填名称)。
(3) 向Y溶液中滴入溴水,溴水褪色,说明Y中含有_____。
(4) Y具有还原性。向Y溶液中滴入几滴酸性KMnO4稀溶液,实验现象为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.在锌与某浓度的盐酸反应的实验中,实验员得到下面的结果:
锌的质量(g) | 锌的形状 | 温度(℃) | 溶解于酸花的时间(s) | |
A | 2 | 薄片 | 5 | 400 |
B | 2 | 薄片 | 15 | 200 |
C | 2 | 薄片 | 25 | 100 |
D | 2 | 薄片 | 35 | 50 |
E | 2 | 薄片 | 45 | 25 |
F | 2 | 粉末 | 15 | 5 |
(1)写出基态Zn2+的核外电子排布式:_____,该反应是_____反应(填“放热”或“吸热”);
(2)仔细观察A~F的实验数据对比,你可以得到关于温度影响反应速率结论,用此结论,计算:55℃时,2g锌薄片溶解于酸中需花 _____s。
II.某可逆反应在某体积为5 L的密闭容器中进行,在从0~4分钟各物质的量的变化情况如图所示(X
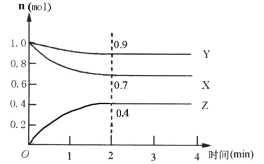
(3)该反应的的化学方程式为__________________;
(4)反应开始至2分钟时,X的平均反应速率为__;
(5)能说明该反应已达到平衡状态的是_________;
a.每消耗1molX,同时生成1.33molZ b.容器内压强保持不变
c.Z的浓度不再变化 d.容器内混合气体的密度保持不变
(6)由下图求得平衡时Y的转化率为__________________。
(7)若保持容器体积不变,充入He,容器内反应速率将_______。(填“增大”“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.100 mol·L-1 AgNO3滴定50.0 mL 0.0500 mol·L-1 Cl-溶液的滴定曲线如图所示。下列有关描述错误的是( )

A.根据曲线数据计算可知Ksp(AgCl)的数量级为10-10
B.曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl)
C.相同实验条件下,若改为0.0500 mol·L-1 Br-,反应终点c向b方向移动
D.相同实验条件下,若改为0.0400 mol·L-1 Cl-,反应终点c移到a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验及现象不能推出相应结论的是
实验 | 现象 | 结论 | |
A | 向2 mL 0.1mol/L的FeCl3溶液中加足量铁粉,振荡,加2滴KSCN溶液 | 黄色逐渐消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
B | 在稀AgNO3溶液中先加入足量0.1mol/L NaCl溶液,再加入少量0.1mol/L NaI溶液 | 先产生白色沉淀,后出现黄色沉淀 | 说明Ksp(AgCl)>Ksp(AgI) |
C | 加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3显碱性 |
D | 常温下,测定等物质的量浓度的Na2CO3和Na2SO4溶液的pH值 | 前者的 pH值比后者的大 | 非金属性:S>C |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向5 mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度关系为
A. AgCl=AgI=Ag2S B. AgCl<AgI<Ag2S
C. AgCl>AgI>Ag2S D. AgI>AgCl>Ag2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑨九种元素在周期表中的位置。
族 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
请按要求回答下列问题:
(1)①~⑨九种元素中非金属性最强的是________(填元素符号)。
(2)元素⑧的原子结构示意图是_________;由①、④、⑥三种元素组成的化合物,其电子式是_________。
(3)元素②、⑧的气态氢化物的稳定性较强的是________________(填化学式);元素③、⑨的最高价氧化物对应的水化物的酸性较强的是________________(填化学式)。
(4)③、④span>、⑧三种元素的原子半径由大到小的顺序是________________(填元素符号)。
(5)元素⑤、⑥组成的化合物的化学键类型是________________________。
(6)元素⑥的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应的离子方程式是________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,铁片、铜片和硫酸铜溶液可以构成原电池或电解池,下列说法不正确的是( )

A.构成原电池时,Cu极反应为![]()
B.构成电解池时,Fe电极质量一定减少
C.构成电解池时,Cu极质量可能增加也可能减少
D.构成的原电池或电解池在工作时的反应原理可能相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池的工作原理为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,研读下图,下列判断不正确的是
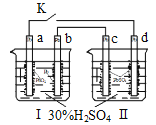
A.K闭合时,d电极反应式:PbSO4+2H2O-2e-=PbO2+4H++SO42-
B.当电路中转移0.2mol电子时,I中消耗的H2SO4为0.2 mol
C.K闭合时,II中SO42-向c电极迁移
D.K闭合一段时间后,II可单独作为原电池,d电极为正极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com