
ЁОЬтФПЁПаХЯЂвЛЃКИѕЭЌФјЁЂюмЁЂЬњЕШН№ЪєПЩвдЙЙГЩИпЮТКЯН№ЁЂЕчШШКЯН№ЁЂОЋУмКЯН№ЕШЃЌгУгкКНПеЁЂгюКНЁЂЕчЦїМАвЧБэЕШЙЄвЕВПУХЁЃаХЯЂЖўЃКТШЛЏИѕѕЃ(CrO2Cl2)ЪЧИѕЕФвЛжжЛЏКЯЮяЃЌГЃЮТЯТИУЛЏКЯЮяЪЧАЕКьЩЋвКЬхЃЌШлЕуЮЊ-96.5ЁцЃЌЗаЕуЮЊ117ЁцЃЌФмКЭБћЭЊ(CH3COCH3)ЁЂЫФТШЛЏЬМЁЂCS2ЕШгаЛњШмМСЛЅШмЁЃ
ЃЈ1ЃЉИѕ(24КХдЊЫи)ЛљЬЌдзгЕФЕчзгХХВМЪНЮЊ____ЁЃ
ЃЈ2ЃЉCH3COCH3ЗжзгжаКЌга____ИіІаМќЃЌКЌга____ИіІвМќЁЃ
ЃЈ3ЃЉЙЬЬЌТШЛЏИѕѕЃЪєгк____ОЇЬхЃЌБћЭЊжаЬМдзгЕФдгЛЏЗНЪНЮЊ____ЃЌЖўСђЛЏЬМЪєгк____ (ЬюЁАМЋадЁБЛђЁАЗЧМЋадЁБ)ЗжзгЃЌЗжзгжаКЌга____(ЬюЁАМЋадЁБЛђЁАЗЧМЋадЁБ)МќЁЃ
ЁОД№АИЁП1s22s22p63s23p63d54s1(Лђ[Ar]3d54s1) 1 9 Зжзг sp3ЁЂsp2 ЗЧМЋад МЋад
ЁОНтЮіЁП
(1) CrдЊЫиЮЊ24КХдЊЫиЃЌдзгКЫЭтга24ИіЕчзгЃЌЫљвдКЫЭтЕчзгХХВМЪНЮЊЃК1s22s22p63s23p63d54s1ЃЌЙЪД№АИЮЊЃК 1s22s22p63s23p63d54s1ЃЛ
(2)CH3COCH3ЗжзгжаКЌгавЛИіЬМбѕЫЋМќЃЌ6ИіЬМЧтМќЕЅМќЃЌ2ИіЬМЬММќЃЌЫљвдКЌга1ИіІАМќЃЌ 9Иі![]() МќЃЛЙЪД№АИЮЊЃК1ЃЛ9ЃЛ
МќЃЛЙЪД№АИЮЊЃК1ЃЛ9ЃЛ
(3)ЗжзгОЇЬхЕФШлЗаЕуНЯЕЭЃЌЙЬЬЌТШЛЏУњѕЃЕФШлЗаЕуНЯЕЭЃЌЫљвдЪєгкЗжзгОЇЬхЃЛдкБћЭЊЗжзгжаЃЌєЪЛљЬМдзгКЌга3Иі![]() МќЧвВЛКЌЙТЕчзгЖдЃЌЫљвдВЩгУsp2дгЛЏЃЌМзЛљЬМдзгКЌга4Иі
МќЧвВЛКЌЙТЕчзгЖдЃЌЫљвдВЩгУsp2дгЛЏЃЌМзЛљЬМдзгКЌга4Иі![]() МќЧвВЛКЌЙТЕчзгЖдЃЌЫљвдВЩгУsp3дгЛЏЃЛЖўСђЛЏЬМЪЧжБЯпаЮЗжзгЃЌЗжзгНсЙЙЖдГЦЃЌе§ИКЕчКЩЕФжааФжиКЯЃЌЪєгкЗЧМЋадЗжзгЃЛВЛЭЌЗЧН№ЪєдЊЫижЎМфаЮГЩМЋадМќЃЌЖўСђЛЏЬМЗжзгжаДцдкSгыCаЮГЩЕФМЋадМќЃЛЙЪД№АИЮЊЃКЗжзгЃЛsp2КЭsp3ЃЛЗЧМЋадЃЛМЋадЁЃ
МќЧвВЛКЌЙТЕчзгЖдЃЌЫљвдВЩгУsp3дгЛЏЃЛЖўСђЛЏЬМЪЧжБЯпаЮЗжзгЃЌЗжзгНсЙЙЖдГЦЃЌе§ИКЕчКЩЕФжааФжиКЯЃЌЪєгкЗЧМЋадЗжзгЃЛВЛЭЌЗЧН№ЪєдЊЫижЎМфаЮГЩМЋадМќЃЌЖўСђЛЏЬМЗжзгжаДцдкSгыCаЮГЩЕФМЋадМќЃЛЙЪД№АИЮЊЃКЗжзгЃЛsp2КЭsp3ЃЛЗЧМЋадЃЛМЋадЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПТСЪЧвЛжжгІгУЙуЗКЕФН№ЪєЃЌЙЄвЕЩЯгУAl2O3КЭБљОЇЪЏЃЈNa3AlF6ЃЉЛьКЯШлШкЕчНтжЦЕУЁЃ
Ђё.ТСЭСПѓЕФжївЊГЩЗжЪЧAl2O3КЭSiO2ЕШЁЃДгТСЭСПѓжаЬсСЖAl2O3ЕФСїГЬШчЭМЃК

ЃЈ1ЃЉаДГіЗДгІ1жаЩцМАЕФШЮвтвЛИіЛЏбЇЗНГЬЪН____ЃЛ
ЃЈ2ЃЉТЫвКЂёжаМгШыCaOЩњГЩЕФГСЕэЪЧ____ЃЌвбжЊЦјЬхAдкБъзМзДПіЯТЕФУмЖШЮЊ1.96g/LЃЌаДГіAЙ§СПЪБЃЌЗДгІ2ЕФРызгЗНГЬЪН____ЃЛ
Ђђ.вдгЉЪЏЃЈCaF2ЃЉКЭДПМюЮЊдСЯжЦБИБљОЇЪЏЕФСїГЬШчЭМЃК

ЃЈ3ЃЉгЉЪЏЃЈCaF2ЃЉЕФЕчзгЪН____ЃЛ
ЃЈ4ЃЉШєEЮЊСђЫсИЦЃЌDЮЊзюЮШЖЈЕФЦјЬЌЧтЛЏЮяЃЌдђЛЏКЯЮяCЪЧ____ЃЌаДГігЩDжЦБИБљОЇЪЏЃЈNa3AlF6ЃЉЕФЛЏбЇЗНГЬЪН____ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПНЋЬњЦЌКЭаПЦЌЗХдкЪЂгаNaClШмвК(ЦфжаЕЮгаЗгЬЊ)ЕФБэУцУѓжаЃЌзщГЩМзЁЂввСНИізАжУ(ШчЭМ)ЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ

A.МзЮЊдЕчГиЃЌИКМЋЗДгІЮЊZn-2e-=Zn2ЃЋ
B.МзЮЊдЕчГиЃЌFeЕчМЋЩЯгаЦјЬхЗХГі
C.ввЮЊЕчНтГиЃЌвѕМЋЗДгІЪНЮЊ2H++2e-=H2Ёќ
D.вЛЖЮЪБМфКѓЃЌМзЁЂввСНБэУцУѓжаШмвКОљгаКьЩЋГіЯж
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгУЛдЭПѓЃЈжївЊГЩЗжЮЊ![]() ЃЌКЌЩйСП
ЃЌКЌЩйСП![]() ЁЂ
ЁЂ![]() ЕШдгжЪЃЉжЦБИФбШмгкЫЎЕФМюЪНЬМЫсЭЕФСїГЬШчЭМЫљЪОЃК
ЕШдгжЪЃЉжЦБИФбШмгкЫЎЕФМюЪНЬМЫсЭЕФСїГЬШчЭМЫљЪОЃК

(1)ЯТСаДыЪЉЮоЗЈМгПьНўШЁЫйТЪЕФЪЧ________ЃЈЬюзжФИЃЉЁЃ
A.бгГЄНўШЁЪБМф B.НЋЛдЭПѓЗлЫщ C.ГфЗжНСАш D.ЪЪЕБдіДѓСђЫсХЈЖШ
(2)ТЫдќЂёжаЕФжївЊГЩЗжЪЧ![]() ЁЂSЁЂ
ЁЂSЁЂ![]() ЃЌЧыаДГіЁАНўШЁЁБЗДгІжаЩњГЩSЕФРызгЗНГЬЪНЃК_________________________ЁЃ
ЃЌЧыаДГіЁАНўШЁЁБЗДгІжаЩњГЩSЕФРызгЗНГЬЪНЃК_________________________ЁЃ
(3)баОПЗЂЯжЃЌШєЯШГ§ЬњдйНўШЁЃЌНўШЁЫйТЪУїЯдБфТ§ЃЌдвђПЩФмЪЧ__________________________ЁЃ
(4)ЁАГСУЬЁБЃЈГ§![]() ЃЉЙ§ГЬжагаЙиЗДгІЕФРызгЗНГЬЪНЮЊ________________________________ЁЃ
ЃЉЙ§ГЬжагаЙиЗДгІЕФРызгЗНГЬЪНЮЊ________________________________ЁЃ
(5)ТЫвКЂђОеєЗЂНсОЇЕУЕНЕФбЮжївЊЪЧ___________ЃЈЬюЛЏбЇЪНЃЉЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПбаОПБэУїЃЌЕиЧђЩЯЕФЬМбЛЗЃЌЙтКЯзїгУЪЧБиВЛПЩЩйЕФЃЈШчЯТЭМЫљЪОЃЉЁЃЯТСаа№Ъіе§ШЗЕФЪЧ

A. ЪЏгЭгыУКЪЧПЩдйЩњФмдД
B. CO2ЪЧУКЁЂЪЏгЭаЮГЩЕэЗлЁЂЯЫЮЌЫиЕШЕФДпЛЏМС
C. ЙтКЯзїгУНЋЬЋбєФмзЊЛЏЮЊЛЏбЇФм
D. ЭМжаЫљГіЯжЕФЮяжЪжаЕэЗлгыЯЫЮЌЫиЮЊЭЌЗжвьЙЙЬх
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПбЧЯѕЫсФЦЙуЗКгУгкУНШОМСЁЂЦЏАзМСЕШЁЃФГаЫШЄаЁзщгУЯТСазАжУжЦШЁНЯДПОЛЕФNaNO2ЁЃ
Мз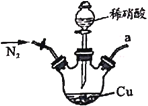 вв
вв Бћ
Бћ ЖЁ
ЖЁ![]()
ЗДгІдРэЮЊЃК2NO+Na2O2=2NaNO2ЁЃвбжЊЃКNOФмБЛЫсадKMnO4бѕЛЏГЩNO3-ЃЌMnO4-БЛЛЙдЮЊMn2+ЁЃЯТСаЗжЮіДэЮѓЕФЪЧ
A.МзжаЕЮШыЯЁЯѕЫсЧАашЭЈШЫN2
B.вЧЦїЕФСЌНгЫГађЮЊa-f-g-d-e-b
C.БћжаCaCl2гУгкИЩдяNO
D.ввжаЮќЪеЮВЦјЪБЗЂЩњЕФРызгЗДгІЮЊ3MnO4-+5NO+4H+=3Mn2++5NO3-+2H2O
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПюбЪЧвЛжжадФмЗЧГЃгХдНЕФН№ЪєЃЌ21ЪРМЭНЋЪЧюбЕФЪРМЭЁЃ
(1)TiO2БЁФЄжаВєдгИѕФмЯджјЬсИпЙтДпЛЏЛюадЁЃЛљЬЌCrдзгЕФКЫЭтЕчзгХХВМЪНЮЊ____ЁЃ
(2)ЫФввДМюбФмдіМгЯ№НКдкН№ЪєБэУцЕФеГИНадЁЃЦфжЦБИдРэШчЯТЃКTiCl4+4CH3CH2OH+4NH3=Ti(OCH2CH3)4+4NH4Cl
ЂйTi(OCH2CH3)4ПЩШмгкгаЛњШмМСЃЌГЃЮТЯТЮЊЕЛЦЩЋЭИУївКЬхЃЌЦфОЇЬхРраЭЮЊ____
ЂкNКЭOЮЛгкЭЌвЛжмЦкЃЌOЕФЕкЖўЕчРыФмДѓгкNЕФЕкЖўЕчРыФмЕФдвђЪЧ_____ЃЛ
ЂлNH4ClжаДцдкЕФзїгУСІга_____ЃЌNH4ClШлЗаЕуИпгкCH3CH2OHЕФдвђЪЧ_____ЃЌTi(OCH2CH3)4ЗжзгжаCдзгЕФдгЛЏаЮЪНОљЮЊ ____ЁЃ
(3)юбЫсяШ(SrTiO3)ПЩзїЕчзгЬеДЩВФСЯКЭШЫдьБІЪЏЃЌЦфжавЛжжОЇАћНсЙЙШчЭМЫљЪОЁЃШєTiЮЛгкЖЅЕуЮЛжУЃЌOЮЛгк____ЮЛжУЃЛвбжЊОЇАћВЮЪ§ЮЊa nmЃЌTiЮЛгкOЫљаЮГЩЕФе§АЫУцЬхЕФЬхаФЃЌдђИУАЫУцЬхЕФБпГЄЮЊ_____ m(СаГіБэДяЪН)ЁЃ
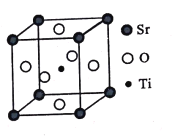
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁППЇЗШЫсОпгажЙбЊЙІаЇЃЌДцдкгкЖржжжавЉжаЃЌЦфНсЙЙМђЪНШчЯТЭМЃЌЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
![]()
A. ПЇЗШЫсПЩвдЗЂЩњШЁДњЁЂМгГЩЁЂбѕЛЏЁЂѕЅЛЏЁЂМгОлЗДгІ
B. 1mol ПЇЗШЫсзюЖрФмгы5 mol H2ЗДгІ
C. ПЇЗШЫсЗжзгжаЫљгадзгПЩФмЙВУц
D. ЗфНКЕФЗжзгЪНЮЊC17H16O4ЃЌдквЛЖЈЬѕМўЯТПЩЫЎНтЩњГЩПЇЗШЫсКЭвЛжжвЛдЊДМAЃЌдђДМA ЕФЗжзгЪНЮЊC8H10O
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГЃЮТЯТЃЌгУpHДЋИаЦїНјааЪ§зжЛЏЪЕбщЃЌЗжБ№ЯђСНИіЪЂ50mL0.100mol/LбЮЫсЕФЩеБжадШЫйЕЮМг50mLШЅРызгЫЎЁЂ50mL0.100mol/L ДзЫсяЇШмвКЃЌЕЮМгЙ§ГЬНјааДХСІНСАшЃЌВтЕУШмвКpHЫцЪБМфБфЛЏШчЭМЫљЪОЁЃвбжЊГЃЮТЯТДзЫсяЇШмвКpHЃН7ЃЌЯТСаЫЕЗЈДэЮѓЕФЪЧ
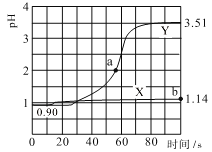
A.ЧњЯпXБэЪОбЮЫсжаМгДзЫсяЇШмвКЯЁЪЭЕФpHБфЛЏ
B.ЧњЯпYЕФpHБфЛЏжївЊЪЧвђЮЊCH3COO-гыH+НсКЯГЩСЫШѕЕчНтжЪ
C.aЕуЖдгІЕФШмвКжаc(Cl-)ЃЋc(CH3COO-)ЃЋc(CH3COOH)Ѓc(NH4+)ЃН0.01mol/L
D.bЕуЖдгІЕФШмвКжаЫЎЕчРыЕФc(H+)ЃН10-12.86 mol/L
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com