分析:(1)根据转移电子和放出热量之间的关系式计算;
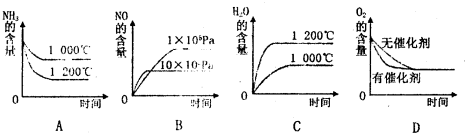
(2)A.升高温度,正逆反应速率都增大,反应达到平衡的时间缩短,平衡向吸热反应方向移动;
B.增大压强,正逆反应速率都增大,反应达到平衡的时间缩短,平衡向气体体积减小的方向移动;
C.升高温度,正逆反应速率都增大,反应达到平衡的时间缩短,平衡向吸热反应方向移动;
D.使用催化剂加快反应速率,缩短反应到达平衡的时间,但平衡不移动;
(3)①先根据v=
计算一氧化氮的反应速率,再根据同一可逆反应中,同一时间段内,各元素的反应速率之比等于其计量数之比确定氧气的反应速率;
②先分析图表,再根据外界对化学平衡的影响分析;
③根据浓度商与化学平衡常数的相对大小判断移动方向;
(4)根据等比数列计算前n项和,再根据其转化率公式计算;
(5)盐酸易挥发导致硝酸中含有氯化氢.
解答:解:(1)将4molNH
3和5molO
2放入容器中,达到平衡时,放出热量0.8akJ,根据氧气和放出热量的关系式知,参加反应的氧气的物质的量=
=4mol,根据氧气和转移电子之间的关系式得,转移电子的物质的量=
=16mol,故答案为:16;
(2)A.升高温度,正逆反应速率都增大,反应达到平衡的时间缩短,平衡向吸热反应方向移动,氨气的含增大,故A错误;
B.增大压强,正逆反应速率都增大,反应达到平衡的时间缩短,平衡向气体体积逆反应方向移动,则一氧化氮的含量减少,故B正确;
C.升高温度,正逆反应速率都增大,反应达到平衡的时间缩短,平衡向逆反应方向移动,则水的含量减少,故C错误;
D.使用催化剂加快反应速率,缩短反应到达平衡的时间,但平衡不移动,则氧气的含量不变,故D正确;
故选AC;
(3)①反应在第2min到第4min时,反应速率v(NO)=
mol/(L.min)=0.6mol/(L.min),同一可逆反应中,同一时间段内,各元素的反应速率之比等于其计量数之比确定氧气的反应速率,则v(O
2)=
mol/(L.min)=0.75mol/(L.min),故答案为:0.75mol/(L.min);
②根据生成物第2min及第4min时物质的量浓度的变化量知,第2min到第4min时反应速率增大,且平衡向正反应方向移动,则第2min时改变了条件,升高温度或使用催化剂,故选AB;
③第6min时,各种物质的浓度不变,说明该反应达到平衡状态,化学平衡常数K=
| (2.0)4.(3.0)6 |
| (2.0)4.(3.0)5 |
=3.0,
Q=
=1<3,则平衡向正反应方向移动,故答案为:正反应;
(4)设起始时NO
2物质的量为1 mol,经过n次循环后生成HNO
3的物质的量为:Sn=
+
×
+
×()2+??????+
×(
)
n-1,经等比数列求和得Sn=
=1-(
)
n,因此,NO
2→HNO
3转化率为
×100%,
×100%=95%,因此,n=2.6≈3,要经过3次循环操作才能使95%的NO
2转化为HNO
3,
故答案为:3;
(5)防止生成易挥发的HCl混入硝酸中,导致得到的硝酸不纯,故答案为:防止生成易挥发的HCl混入硝酸中.



 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案

 4NO(g)+6H2O (g)+1025 kJ
4NO(g)+6H2O (g)+1025 kJ 