
【题目】城市地下潮湿的土壤中常埋有纵横交错的管道和输电线路,当有电流泄漏并与金属管道形成回路时,就会引起金属管道的腐蚀。原理如图所示,但若电压等条件适宜,钢铁管道也可能减缓腐蚀,此现象被称为“阳极保护”。下列有关说法正确的是( )

A.该装置能够将化学能转化为电能
B.管道右端腐蚀比左端快,右端电极反应式为Fe-2e-═Fe2+
C.如果没有外加电源,潮湿的土壤中的钢铁管道比较容易发生析氢腐蚀
D.钢铁“阳极保护“的实质是在阳极金属表面形成一层耐腐蚀的钝化膜
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
【题目】金属钒被誉为“合金的维生素”。从废钒(主要成分为V2O5、Fe2O3、SiO2等)中回收V2O5的一种工艺流程如下图所示:

已知:
步骤②、③中的变化过程可简化为:Rn+(水层)+nHA(有机层)![]() RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
回答下列问题:
(1)步骤D酸浸过程中发生氧化还原反应的化学方程式为______________________。
(2)萃取时应加入适量碱的作用是___________________。
(3)步骤④中反应的离子方程式为___________________。
(4)步骤⑤加入氨水调节溶液pH=2,钒沉淀率达到93%且不产生Fe(OH)3沉淀,则此时溶液中c(Fe3+)<_____mol/L(按25℃计算,25℃时Ksp[Fe(OH)3]=2.6×10-39)。所得NH4VO3为离子化合物,NH4+的电子式为_______。
(5)V2O5是两性氧化物,在强酸性溶液中以VO2+形式存在,VO2+具有强氧化性,能将I-氧化为I2,本身被还原为V0+,则V2O5与氢碘酸反应的离子方程式为_________________。
(6)为提高钒的回收率,步骤②和③需多次进行,假设酸浸所得“强酸性浸出液”中c(VO2+)=amol/L,步骤②和③每进行一次,VO2+萃取率为80%,4次操作后,“强酸性浸出液中”c(VO2+)=_______mol/L(萃取的量=![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是重要的工业原料,在农业、医药、国防和化工等领域有重要应用。
I.(1)工业上用N2和H2在一定条件下合成氨,下列措施能使正反应速率增大,且使平衡混合物中NH3的体积分数一定增大的是________。
A.降低反应温度 B.压缩反应混合物 C.充入N2 D.液化分离NH3
(2)常温下向100mL0.2mo/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O物质的量分数与加入盐酸的体积的关系如下图所示,根据图像回答下列问题。

①表示NH3·H2O浓度变化的曲线是__________(填“A”或“B")。
②NH3·H2O的电离常数为_______(已知lg1.8 = 0.26)。
③当加入盐酸体积为50ml时,溶被中c(NH4+)- c(NH3·H2O) =_____mol/L (用数字表示)。
Ⅱ.若液氨中也存在类似水的电离( H2O+H2O![]() H3O+ +OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
H3O+ +OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
(1)写出液氨的电离方程式_________.
(2)写出碳酸钠溶于液氨后第一级氨解的离子方程式__________
(3)写出碳酸钠的液氨溶液中各离子浓度的大小关系____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法正确的是( )
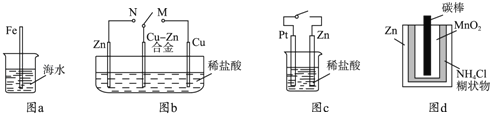
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu﹣Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn﹣MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度、相同浓度下的八种溶液,其pH由小到大的顺序如图所示,图中①②③④⑤代表的物质可能分别为
![]()
A. NH4Cl (NH4)2SO4 CH3COONa NaHCO3 NaOH
B. (NH4)2SO4 NH4Cl CH3COONa NaHCO3 NaOH
C. (NH4)2SO4 NH4Cl NaOH CH3COONa NaHCO3
D. CH3COOH NH4Cl (NH4)2SO4 NaHCO3 NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙烯醇肉桂酸酯(M)可用作光刻工艺中的抗腐蚀涂层,其合成路线如下:

已知:R1—CHO+R2—CH2CHO![]() CHOHR1CHCHOR2
CHOHR1CHCHOR2
请回答:
(1)C的化学名称为______________;M中含氧官能团的名称为____________。
(2)F→G的反应类型为__________;
检验产物G中新生成官能团的实验方法为______________________________。
(3)C→D的化学方程式为________________________________________。
(4)E的结构简式为_______________________;
H的顺式结构简式为_____________________________。
(5)同时满足下列条件的F的同分异构体有________种(不考虑立体异构);
①属于芳香族化合物 ②能发生水解反应和银镜反应
其中核磁共振氢谱有4种吸收峰的物质的结构简式为_________________(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定0.1 mol·L-1 Na2SO3溶液先升温再降温过程中的pH,数据如下。
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。
下列说法不正确的是
A. Na2SO3溶液中存在水解平衡:![]() +H2O
+H2O![]()
![]() +OH
+OH
B. ④的pH与①不同,是由于![]() 浓度减小造成的
浓度减小造成的
C. ①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D. ①与④的Kw值相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】厌氧氨化法(Anammox)是一种新型的氨氮去除技术,下列说法中不正确的是

A. 1mol NH4+ 所含的质子总数为10NA
B. 联氨(N2H4)中含有极性键和非极性键
C. 过程II属于氧化反应,过程IV属于还原反应
D. 过程I中,参与反应的NH4+与NH2OH的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定有机物中碳和氢的质量分数,常用的方法是燃烧分析法,用氧化铜作催化剂,在750 ℃左右使有机物在氧气流中全部氧化成CO2和H2O,分别用装有固体NaOH和固体Mg(ClO4)2(高氯酸镁)的吸收管吸收CO2和H2O。某课外活动小组,设计用下列装置制取乙烯,并测定乙烯分子中碳、氢原子个数比,甲为燃烧管,当乙烯和氧气通过时,由于催化剂的存在而不会发生爆炸,乙烯将被氧化成CO2和H2O。
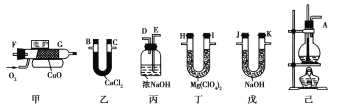
请回答下列问题:
(1)整套装置的连接顺序(按从左到右顺序用字母填写): ____接____,____接____,____接____,____接____,____接___.
(2)烧瓶中的试剂是浓H2SO4和酒精,其中浓H2SO4的作用是___________,在烧瓶中还要加少量碎瓷片,其作用是__________。
(3)实验时应使烧瓶中溶液温度迅速升至170 ℃,原因是____________________。实验结束时,烧瓶中有黑色物质生成,其原因是__________。
(4)乙、丙装置的作用分别是:乙:____________________;丙:_____________________。
(5)若实验前后,丁增重a g,戊增重b g,则测得乙烯分子中C、H原子个数比为__________。
(6)若测得C/H值偏高,导致这种误差的可能原因是(_____)
A.乙烯中混有少量乙醚(C2H5OC2H5)
B.乙烯进入燃烧管时,仍含有少量水蒸气
C.乙烯中混有少量CO
D.乙烯进入燃烧管时,仍含有少量CO2
(7)若仍用上述装置测定某烃A的化学式,经测定丁增重4.5 g,戊增重8.8 g,则A的最简式为__________;若要确定A的化学式,是否还需要其他数据(若需要,说明还需测定哪些数据;若不需要,说明其原因)?_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com