
【题目】Cu—Mn—Al合金为磁性形状记忆合金材料之一,可用来制作各种新型的换能器、驱动器、敏感元件和微电子机械操纵系统。
(1)下列状态的铝中,最外层电离出一个电子所需能量最小的是______(填标号)。
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
(2)AlCl3是某些有机反应的催化剂,如苯与乙酰氯反应的部分历程为:

①乙酰氯分子中碳原子的杂化类型为____。
②乙酰氯分子中∠CCCl___120°(填“>”、“=”或“<”),判断理由是_______。
③![]() 的空间构型为________。
的空间构型为________。
(3)温度不高时气态氯化铝为二聚分子(其结构如图所示)。

写出Al2Cl6的结构式并标出配位键______。
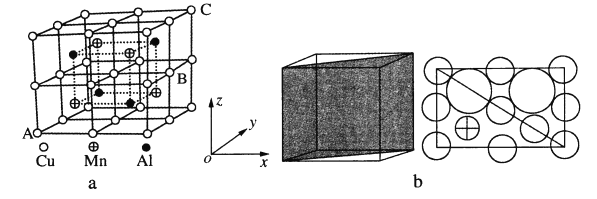
(4)Cu—Mn—合金的晶胞如图a所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置,图b是沿立方格子对角面取得的截图。
①若A原子的坐标参数为(0,0,0),C为(1,1,1),则B原子的坐标参数为_____。
②由晶胞可知该合金的化学式为_____。
③已知r(Cu)≈r(Mn)=127pm,r(Al)=143pm,则Cu原子之间的最短核间距离为____pm。
④该晶胞的密度为_____g·cm-3。(列出计算式即可,阿伏加德罗常数用NA表示)
【答案】B sp3sp2 < 双键对单键的排斥力大于单键对单键的排斥力 正四面体 ![]() (1,
(1,![]() ,
,![]() ) AlMnCu2 180
) AlMnCu2 180![]() 或
或![]() 或311.76
或311.76 
【解析】
(1)铝的第三电离能>第二电离能>第一电离能,基态大于激发态,ACD属于基态、B属于激发态,所以电离最外层一个电子所需能量最小的是B;
(2)①根据乙酰氯分子的结构可知该物质中甲基上的C原子形成4个σ键,价层电子对数为4,为sp3杂化;另一个C原子形成3个σ键,1个π键,所以价层电子对数为3,为sp2杂化;
②双键对单键的排斥力大于单键对单键的排斥力,所以乙酰氯分子中∠CCCl小于120°;
③![]() 中心铝原子的价层电子对数为
中心铝原子的价层电子对数为![]() =4,不含孤电子对,所以为正四面体形;
=4,不含孤电子对,所以为正四面体形;
(3)根据氯化铝二聚分子的结构可知每个氯原子与4个氯原子形成4个σ键,由于铝原子最外层有只有3个电子,所以其中一个为配位键,由铝提供空轨道,氯原子提供孤电子对,所以Al2Cl6的结构式为![]() ;
;
(4)①A为原点,C为(1,1,1),B为右面面心,所以B的坐标为(1,![]() ,
,![]() );
);
②根据均摊法,该晶胞中Cu原子的个数为![]() =8,Mn原子的个数为4,Al原子的个数为4,所以该合金的化学式为AlMnCu2;
=8,Mn原子的个数为4,Al原子的个数为4,所以该合金的化学式为AlMnCu2;
③根据截面图结合几何知识可知[2r(Cu)+2r(Al)]为体对角线的一半,设晶胞的棱长为a,则有![]() a=2[2r(Cu)+2r(Al)]=4×(127+143)pm,所以a=
a=2[2r(Cu)+2r(Al)]=4×(127+143)pm,所以a=![]() pm;根据晶胞结构可知铜原子之间的最短核间距为棱长的一半,即
pm;根据晶胞结构可知铜原子之间的最短核间距为棱长的一半,即![]() a=180
a=180![]() pm或
pm或![]() pm或311.76pm;
pm或311.76pm;
④晶胞的质量m=![]() g,晶胞的体积V=a3=(
g,晶胞的体积V=a3=(![]() )3pm3=(
)3pm3=(![]() ×10-10)3cm3,所以晶胞的密度
×10-10)3cm3,所以晶胞的密度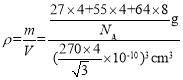 =
=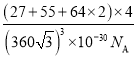 g·cm-3。
g·cm-3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列各图均能表示甲烷的分子结构,按要求回答下列问题。
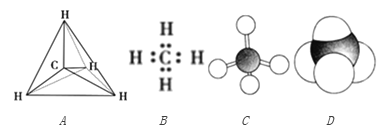
(1)甲烷的比例模型是________,甲烷的电子式是__________ (填序号)。
(2)写出甲烷与氯气发生反应的化学方程式_____________(只写第一步),该反应的反应类型是________________。
(3)相对分子质量为100的烷烃的分子式是_______________。
(4)甲烷与丙烷互为________。
A. 同位素 B. 同素异形体 C. 同系物 D. 同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
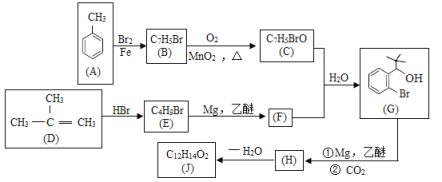
【题目】有机物J是我国自主研发的一类新药,它属于酯类,分子中除苯环外还含有一个五元环。合成J的一种路线如下:
已知:
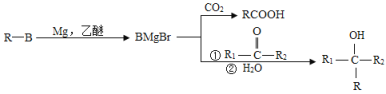
回答下列问题:
(1)B的结构简式是______;C中的官能团名称是____。
(2)D生成E的化学方程式为________。
(3)H→J的反应类型是_________。
H在一定条件下自身缩聚生成高分子化合物的结构简式是_______。
(4)根据![]() ,X的分子式为_____。X有多种同分异构体,其中满足下列条件的同分异构体共有______ 种(已知:碳碳叁键或碳碳双键不能与羟基直接相连)。
,X的分子式为_____。X有多种同分异构体,其中满足下列条件的同分异构体共有______ 种(已知:碳碳叁键或碳碳双键不能与羟基直接相连)。
A.除苯环外无其他环,且无-O-O-键
B.能与FeCl3溶液发生显色反应
C.苯环上一氯代物只有两种
(5)利用题中信息和所学知识,写出以甲烷和甲苯为原料,合成 路线流程图(其它试剂自选):_______。
路线流程图(其它试剂自选):_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用海底锰结核(主要成分为MnO2,含少量MgO、Fe2O3、Al2O3、SiO2)为原料,制备金属锰、镁的一种工艺流程路线如下:
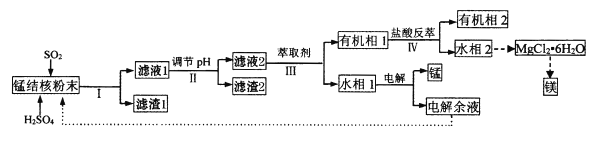
已知:①几种难溶物的溶度积(25℃)如下表所示:
化学式 | Mg(OH)2 | Mn(OH)2 | Al(OH)3 | Fe(OH)3 |
Ksp | 1.8×10-11 | 1.8×10-13 | 1.0×10-33 | 4.0×10-38 |
②溶液中某离子浓度≤1.0×10-6mol·L-1时,认为该离子沉淀完全。
完成下列问题:
(1)“锰结核粉末”中MnO2与SO2反应的离子方程式为_____。
(2)“滤液1”中c(Mn2+)为0.18mol·L-1,则“调节pH”的范围为_______,“滤渣2”的成分为______。
(3)“Ⅲ”处“萃取剂”萃取的成分是___;“Ⅳ”处用“盐酸反萃”的作用是____。
(4)MgCl2·6H2O制取无水MgCl2时,需要在干燥的HCl气流中加热分解。HCl的作用为__________。
(5)该工艺流程中除电解余液可循环利用外,还能循环利用的试剂为____。
(6)一种海生假单孢菌(采自太平洋深海处),在无氧条件下以醋酸为电子供体还原MnO2生成Mn2+的机理如图所示。写出反应②③的总反应的离子方程式____________。
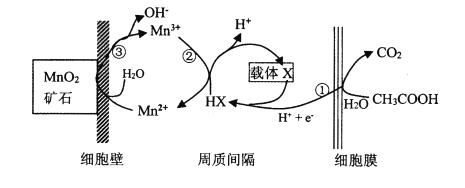
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化钛是一种新型功能性材料,它可由钛粉和氮气在一定条件下进行制备。
(1)基态钛原子的核外电子排布式为________,1 mol N2中含有________molσ键。
(2)钛也可与C、O等元素形成二元化合物,C、N、O元素的电负性由大到小的顺序是________。
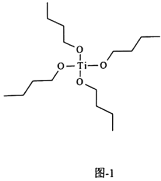
(3)氮化钛也可由钛酸四丁酯[Ti(OC4H9)4]为原料进行制备,钛酸四丁酯结构如图1。其中碳原子的杂化类型为________。该配合物中的配位原子为________。
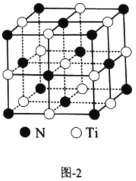
(4)有一种氮化钛晶体的晶胞如图2所示,该晶体的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新冠疫情期间使用大量的消毒剂,其中二氧化氯(ClO2)与亚氯酸钠(NaClO2)都具有强氧化性。两者作漂白剂时,不伤害织物;作饮用水消毒剂时,不残留异味。某研究性学习小组利用如下装置由二氧化氯制备NaClO2·3H2O,并探究其性质。
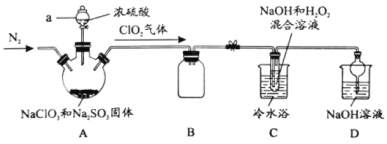
查阅资料:
①ClO2易与碱反应生成亚氯酸盐和氯酸盐。
②NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
回答下列问题:
(1)仪器a的名称_________。
(2)装置A中发生反应的化学方程式:________。
(3)如果撤去C装置中的冷水浴,导致产品中可能混有的杂质是_______。
(4)若要从装置C反应后的溶液获得无水NaClO2晶体的操作步骤如下,请完成下列操作步骤③的内容。
①减压,55℃蒸发结晶; ②趁热过滤;③_________; ④低于60℃干燥,得到成品。
(5)写出装置C反应的离子方程式________。
(6)实验结束后,继续通入一段时间N2的目的是________。
(7)利用题中原理制备出NaClO2·3H2O晶体的试样,可以用“间接碘量法”测定试样(杂质与I-不发生反应)的纯度,过程如下:(已知:I2+2![]() =
=![]() +2I-)取样品0.6000 g配制成250 mL溶液,从中取出25.0 mL加入足量KI固体和适量稀硫酸,再滴加几滴淀粉溶液,然后用0.0600 mol/L Na2S2O3标准溶液滴定,当出现________(填实验现象),达到滴定终点,共消耗该标准溶液25.00 mL,经计算该试样中NaClO2·3H2O的百分含量为______(结果保留3位有效数字)。
+2I-)取样品0.6000 g配制成250 mL溶液,从中取出25.0 mL加入足量KI固体和适量稀硫酸,再滴加几滴淀粉溶液,然后用0.0600 mol/L Na2S2O3标准溶液滴定,当出现________(填实验现象),达到滴定终点,共消耗该标准溶液25.00 mL,经计算该试样中NaClO2·3H2O的百分含量为______(结果保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国自主研发的对二甲苯绿色合成项目取得新进展,其合成过程如图所示。

下列说法不正确的是
A. 异戊二烯所有碳原子可能共平面
B. 可用溴水鉴别M和对二甲苯
C. 对二甲苯的一氯代物有2种
D. M的某种同分异构体含有苯环且能与钠反应放出氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
张亭栋研究小组受民间中医启发,发现As2O3(俗称砒霜)对白血病有明显的治疗作用.氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途.回答下列问题:
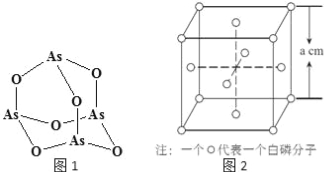
(1)As原子的核外电子排布式为 。
(2)P和S是同一周期的两种元素,P的第一电离能比S大,原因是 。
(3)NH4+中H﹣N﹣H的键角比NH3中H﹣N﹣H的键角 (填“大”或“小”),原因是 。
(4)Na3AsO4中含有的化学键类型包括 ;AsO43﹣的空间构型为 ,As4O6的分子结构如图1所示,则在该化合物中As的杂化方式是 。
(5)化合物NH5中的所有原子最外层都满足稳定结构,则NH5是 晶体.
(6)白磷(P4)的晶体属于分子晶体,其晶胞结构如图2(小圆圈表示白磷分子).己知晶胞的边长为a cm,阿伏加德罗常数为NA mol﹣l,则该晶胞中含有的P原子的个数为 ,该晶体的密度为 gcm﹣3(用含NA、a的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确解释下列反应原理,并且其离子方程式书写正确的是( )
A.泡沫灭火器中Al2(SO4)3和NaHCO3溶液混合:Al3++3HCO![]() =Al(OH)3↓+3CO2↑
=Al(OH)3↓+3CO2↑
B.用小苏打治疗胃酸过多:CO![]() +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
C.电解MgCl2饱和溶液制取Mg:MgCl2![]() Mg+Cl2↑
Mg+Cl2↑
D.用明矾作净水剂:Al3++3H2O=Al(OH)3↓+3H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com