
【题目】氮化钛是一种新型功能性材料,它可由钛粉和氮气在一定条件下进行制备。
(1)基态钛原子的核外电子排布式为________,1 mol N2中含有________molσ键。
(2)钛也可与C、O等元素形成二元化合物,C、N、O元素的电负性由大到小的顺序是________。
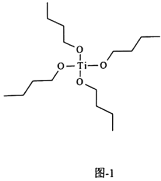
(3)氮化钛也可由钛酸四丁酯[Ti(OC4H9)4]为原料进行制备,钛酸四丁酯结构如图1。其中碳原子的杂化类型为________。该配合物中的配位原子为________。
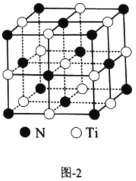
(4)有一种氮化钛晶体的晶胞如图2所示,该晶体的化学式为________。
【答案】1s22s22p63s23p63d24s2(或为[Ar] 3d24s2) 1 O>N>C sp3 O TiN
【解析】
(1)Ti是22号元素,根据构造原理,可得基态钛原子的核外电子排布式;N2分子中2个N原子形成3个共价键,共价三键中含有1个σ键,2个π键;
(2)元素的非金属性越强,其电负性就越大;
(3)根据原子形成的化学键数目判断其杂化类型;Ti原子具有空轨道,OC4H9中的O原子提供孤电子对;
(4)利用均摊方法计算晶体的化学式。
(1)Ti是22号元素,根据构造原理,可得基态钛原子的核外电子排布式为:1s22s22p63s23p63d24s2或简写为[Ar] 3d24s2;N2分子中2个N原子形成3个共价键,结构式是N≡N,2个N原子通过共价三键结合,其中含有1个σ键,2个π键,则1 mol N2中含有1 mol σ键;
(2)元素的非金属性越强,其电负性就越大。C、N、O是同一周期的元素,由于元素的非金属性:O>N>C,所以三种元素的电负性由大到小的顺序是:O>N>C;
(3)在络合物钛酸四丁酯[Ti(OC4H9)4]中,配位体OC4H9的C原子形成4个共价键,因此C原子杂化类型为sp3杂化;中心离子Ti4+提供空轨道,配位体OC4H9中的O原子提供孤对电子对,所以该配合物中的配位原子是O原子;
(4)根据晶胞结构可知:N原子数目为:8×![]() +6×
+6×![]() =4;含有的Ti原子数目为:12×
=4;含有的Ti原子数目为:12×![]() +1=4,所以该晶体的化学式为TiN。
+1=4,所以该晶体的化学式为TiN。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知A为常见温室气体,B为淡黄色氧化物,C为常见液体,D为黄绿色气体单质,相互反应的关系如右图所示,M的水溶液能杀菌消毒。下列有关叙述正确的是
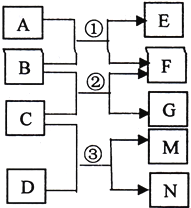
A. 4.4gA含有4.4NA个质子
B. 7.8gB与足量A发生反应①,共转移0.2NA电子
C. 反应③的离子方程式为:Cl2+H2O![]() 2H++Cl-+ ClO-
2H++Cl-+ ClO-
D. M的电子式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)取300 mL 0.2 mol/L的 KI溶液与一定量的酸性 KMnO4 溶液恰好反应,生成等物质的量的 I2和 KIO3,则消耗 KMnO4的物质的量是___mol。
(2)在 Fe(NO3)3 溶液中加入 Na2SO3 溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是___,又变为棕黄色的原因是(用离子方程式解释)____。
(3)在 100 mLFeBr2 溶液中通入标准状况下3.36 L Cl2,溶液中有![]() 的 Br -被氧化成单质 Br2,则原 FeBr2溶液中 FeBr2 的物质的量浓度为_____mol/L。
的 Br -被氧化成单质 Br2,则原 FeBr2溶液中 FeBr2 的物质的量浓度为_____mol/L。
(4)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3。
①写出该反应的化学方程式____。
②NF3无色、无臭,但一旦在空气中泄漏,还是易于发现,判断该气体泄漏时的现象是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是( )
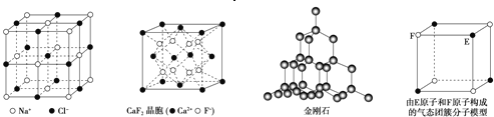
A.在NaCl 晶体中,距Na 最近的Cl 形成正八面体
B.在![]() 晶体中,每个晶胞平均占有4 个Ca2+
晶体中,每个晶胞平均占有4 个Ca2+
C.在金刚石晶体中,碳原子与碳碳键个数的比为1:2
D.该气态团簇分子的分子式为EF或FE
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2A为二元弱酸。室温下,下列指定溶液中微粒物质的量浓度关系正确的是(忽略溶液混合引起的体积变化)( )
A.0.1mol/LH2A溶液:c(H2A)>c(HA-)>c(A2-)>c(H+)
B.0.1mol/LNaHA溶液(pH<7):c(Na+)>c(HA-);c(H2A)>c(A2-)
C.0.1mol/LNaHA溶液和0.1mol/LNaOH溶液等体积混合:c(OH-)=c(H+)+c(HA-)+2c(H2A)
D.0.1mol/LNaHA溶液(pH<7)和0.1mol/LH2A溶液等体积混合:c(Na+)>c(HA-)+2c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
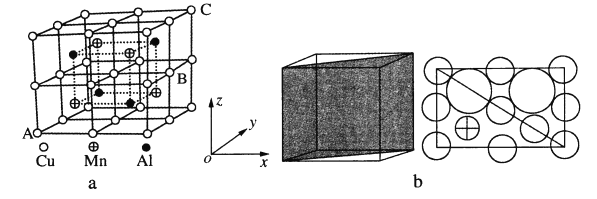
【题目】Cu—Mn—Al合金为磁性形状记忆合金材料之一,可用来制作各种新型的换能器、驱动器、敏感元件和微电子机械操纵系统。
(1)下列状态的铝中,最外层电离出一个电子所需能量最小的是______(填标号)。
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
(2)AlCl3是某些有机反应的催化剂,如苯与乙酰氯反应的部分历程为:

①乙酰氯分子中碳原子的杂化类型为____。
②乙酰氯分子中∠CCCl___120°(填“>”、“=”或“<”),判断理由是_______。
③![]() 的空间构型为________。
的空间构型为________。
(3)温度不高时气态氯化铝为二聚分子(其结构如图所示)。

写出Al2Cl6的结构式并标出配位键______。
(4)Cu—Mn—合金的晶胞如图a所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置,图b是沿立方格子对角面取得的截图。
①若A原子的坐标参数为(0,0,0),C为(1,1,1),则B原子的坐标参数为_____。
②由晶胞可知该合金的化学式为_____。
③已知r(Cu)≈r(Mn)=127pm,r(Al)=143pm,则Cu原子之间的最短核间距离为____pm。
④该晶胞的密度为_____g·cm-3。(列出计算式即可,阿伏加德罗常数用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列问题:
(1)研究发现,在CO2低压合成甲醇反应(CO2+3H2 === CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
Co基态原子核外电子排布式为________,元素Mn与O中,第一电离能较大的是_____,基态原子核外未成对电子数较多的是________。
(2)我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。
回答下列问题:
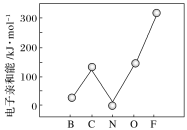
①氮原子的价电子排布图为_________。
②元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是________;氮元素的E1呈现异常的原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛是现在老百姓最关心的一个热点问题,甲醛已经被世界卫生组织认定为一类致癌物。我国科学家研制出一种催化剂,能在室温下高效催化空气中甲醛的氧化,其反应如下:HCHO+O2![]() CO2+H2O。下列有关说法正确的是( )
CO2+H2O。下列有关说法正确的是( )
A.反应物和生成物都含有π键
B.0.5molHCHO含有1molσ键
C.HCHO、CO2中心原子杂化类型相同
D.HCHO能溶解在H2O中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有80多种元素,是重要的物质资源宝库,同时海水具有强大的自然调节能力,为解决环境污染问题提供了广阔的空间。
(1)①已知不同pH条件下,水溶液中碳元素的存在形态如下图所示。下列说法不正确的是______________(填字母序号)。

a.pH=8时,溶液中含碳元素的微粒主要是HCO3-
b.A点,溶液中H2CO3和HCO3-浓度相同
c.当c(HCO3-)=c(CO32-)时,c(H+)>c(OH -)
②向上述pH=8.4的水溶液中加入NaOH溶液时发生反应的离子方程式是______________。
(2)海水pH稳定在7.9—8.4之间,可用于烟道气中CO2和SO2的吸收剂。
①海水中含有的OH -可以吸收烟道气中的CO2同时为海水脱钙,生产CaCO3。写出此反应的离子方程式:__________。
②已知:25℃时,H2CO3电离平衡常数K1=4.3×10-7 K2=5.6×10 -11
H2SO3电离平衡常数K1=1.5×10-2 K2 =6.0×10-8
海水中含有的HCO3-可用于吸收SO2,该过程的离子方程式是_______________。
(3)洗涤烟气后的海水呈酸性,需处理后再行排放。与新鲜海水混合同时鼓入大量空气排出部分CO2,是一种处理的有效方式。
①通入O2可将酸性海水中的硫(IV)氧化,该反应的离子方程式是_______________。
②上述方式使处理后海水pH升高的原因是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com