
【题目】某研究小组为探究影响过氧化氢分解的因素,做了三个实验,相应的实验结果如图1所示(实验1、 实验2均在最适宜条件下进行,实验3其他条件适宜),请分析回答:
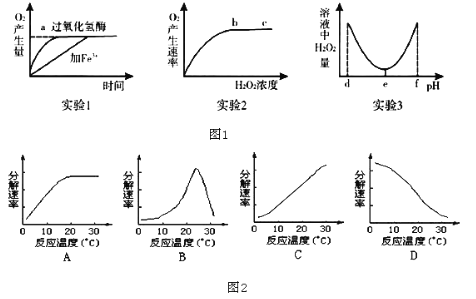
(1)实验1,2,3中的自变量分别为______、______、______。
(2)实验2结果反映,在b、c所对应的H2O2浓度范围内,过氧化氢溶液浓度会______(填“升高”“降低”或“不影响”)过氧化氢酶的活性,bc段O2产生速率不再增大的原因最可能是______。
(3)实验1若温度升高到10℃,加过氧化氢酶的催化反应曲线斜率将______(填“增大”或“减小”);加Fe3+的催化反应曲线斜率将______(填“增大”或“减小”)。
(4)实验3的结果显示,过氧化氢酶的最适pH为______,实验结果表明,当pH小于d或大于f时,过氧化氢的活性将永久丧失,其原因是______。
(5)如图2能正确表示温度对唾液淀粉酶活性影响曲线的是______。
【答案】(1)催化剂的种类 H2O2浓度 pH
(2)不影响 酶的数量有限
(3)减小 增大
(4)e 酶的空间结构被破坏
(5)C
【解析】(1)由图1中各曲线图分析可知,实验1,2,3中的自变量分别为催化剂的种类、H2O2浓度、pH。
(2)实验2结果反映,在b、c所对应的H2O2浓度范围内,过氧化氢溶液浓度会不影响过氧化氢酶的活性,be段O2产生速率不再增大的原因最可能是酶的数量有限。
(3)实验1在适宜条件下进行,若温度升高10℃,加过氧化氢酶的活性将会降低,其催化的反应曲线斜率将减小;温度升高,过氧化氢本身也会分解,故加Fe3+的催化反应曲线斜率将增大。
(4)实验3的结果显示,pH为e时,溶液中H2O2的剩余量最少,说明pH为e时,过氧化氢酶的活性最强,过氧化氢酶的最适pH为e,实验结果表明,当pH小于d或大于f时,酶的空间结构被破坏,导致过氧化氢的活性永久丧失。
(5)唾液淀粉酶的最适温度约为37℃,在37℃前,唾液淀粉酶的活性随温度升高而增强,所以图2中能正确表示温度对唾液淀粉酶活性影响曲线的是C。


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】1905年德国化学家哈伯发明了合成氨的方法,他因此获得了1918年度诺贝尔化学奖.氨的合成不仅解决了地球上因粮食不足而导致的饥饿与死亡问题,在国防、能源、轻工业方面也有广泛用途.
Ⅰ.以氨为原料,合成尿素的反应原理为:
2NH3(g)+CO2(g)═CO(NH2)2(l)+H2O(g)△H=a kJ/mol.
为研究平衡时CO2的转化率与反应物投料比( ![]() )及温度的关系,研究小组在10L恒容密闭容器中进行模拟反应,并绘出如图(Ⅰ、Ⅱ曲线分别表示在不同投料比时,CO2的转化率与温度之间的关系).
)及温度的关系,研究小组在10L恒容密闭容器中进行模拟反应,并绘出如图(Ⅰ、Ⅱ曲线分别表示在不同投料比时,CO2的转化率与温度之间的关系).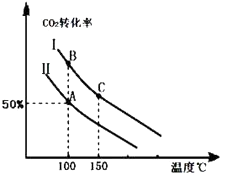
(1)a0 (填“>”或“<”),判断依据是 .
(2)①投料比:Ⅱ(填“>”或“<”).
②若n(CO2)起始=10mol,曲线Ⅱ的投料比为0.4,在100℃条件下发生反应,达平衡至A点,则A点与起始压强比为 .
③A点平衡常数与B点平衡常数间的关系:KAKB(填“>”或“<”或“=”).B点正反应速率与C点正反应速率间的关系为:v(B)v(C)(填“>”或“<”或“=”).
(3)若按曲线Ⅰ的投料比投料,在上述实验中压缩容器体积至5L,在图中画出反应达平衡时的二氧化碳的转化率与温度之间的关系曲线.
(4)为提高CO2转化率可以采取的措施是 .
a.使用催化剂 b.及时从体系中分离出部分CO(NH2)2c.将体系中的水蒸气液化分离
氨气可用于工业上生产硝酸,其尾气中的NO2可用氨水吸收生成硝酸铵,25℃时,将10molNH4NO3溶于水,溶液显酸性,向该溶液中滴加1L某浓度的氨水,溶液呈中性,则滴加氨水的过程中水的电离平衡将(填“正向”、“逆向”或“不”) 移动,此中性溶液中NH3H2O的物质的量为mol.(25℃时,NH3H2O的电离平衡常数Kb=2×10﹣5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下列叙述正确的是( )
A.0.1molL﹣1的NaCl溶液中Cl﹣的数目为0.1NA
B.16g O3中所含的氧原子数为NA
C.22.4L H2中含有的氢原子数一定为2NA
D.1mol Cl2与过量的金属钠充分反应后,转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.氯化铝溶液中加入过量氨水:Al3++4NH?H2O═AlO2﹣+4NH4++2H2O
B.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O ![]() Fe(OH)3+3H+
Fe(OH)3+3H+
C.碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O
D.氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下列仪器和药品制取并收集干燥纯净的氯气.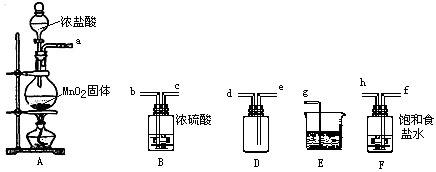
(1)盛有浓盐酸的仪器名称是 .
(2)按气流从左到右,装置正确的连接是:a 接、接、接、接(填各接口字母)
(3)装置F 的作用是 , 装置B 的作用是 .
(4)装置E 中发生反应的化学方程式是 .
(5)装置A 中发生反应的化学方程式是 , 若A 中有4.48L氯气产生(标准状态下),则参加反应的HCl有g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.金属钠投入到水中:Na+2H2O=Na++2OH﹣+H2↑
B.CaCO3与盐酸反应:CO ![]() +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
C.Ca(OH)2溶液与CO2反应:Ca2++2OH﹣+CO2=CaCO3↓+H2O
D.实验室用浓盐酸和二氧化锰反应:MnO2+2H++2Cl﹣ ![]() Mn2++Cl2↑+H2O
Mn2++Cl2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关元素周期表的说法中错误的是( )
A. 元素周期表中第16个纵行为ⅥA族
B. ⅦA族元素也称为卤族元素
C. 元素周期表中,Ⅷ族包括第8,9,10三个纵行
D. 0族元素的原子最外层电子数均为8,元素化合价为0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:HCl+NH3=NH4Cl(固体)如图所示,抽去装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度.下列说法正确的是( ) 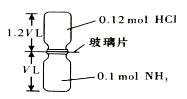
A.反应后瓶内压强是反应前的 ![]()
B.装置中氢元素的总质量为0.42 g
C.生成物的分子数目为0.1 NA
D.反应结束后,两个集气瓶很容易分开
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将少量的铝投入过量的氢氧化钠溶液中充分反应,下列有关所得混合溶液的叙述正确的是( ) 
A.该溶液中,Ag+、K+、NH4+、SO42﹣可以大量共存
B.该溶液中,Na+、OH﹣、NO3﹣、CO32﹣不能大量共存
C.向该溶液中逐滴加入AlCl3溶液,生成沉淀与加入AlCl3溶液关系如图
D.向该溶液中逐滴加入稀盐酸,生成沉淀与加入稀盐酸关系如图
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com