
【题目】在不同情况下测得A(g)+3B(g)![]() 2C(g)+2D(g)的下列反应速率,其中反应速率最大的是
2C(g)+2D(g)的下列反应速率,其中反应速率最大的是
A. υ(D)=0.01 molL-1s-1 B. υ(C)=0.5 molL-1min-1
C. υ(B)=0.6 molL-1min-1 D. υ(A)=0.2molL-1min-1
【答案】A
【解析】
同一化学反应中,同一时间段内,各物质的反应速率之比等于其计量数之比;先把不同物质的反应速率换算成同一物质的反应速率进行比较,从而确定选项。
同一化学反应中,同一时间段内,各物质的反应速率之比等于其计量数之比;把各物质的反应速率换算成A物质的化学反应速率判断。
A、v(D)=0.01 molL-1s-1=0.6mol/(Lmin),v(A)=0.3mol/(Lmin);
B、υ(C)=0.5mol/(Lmin),v(A)=0.25mol/(Lmin);
C、v(B)=0.6 mol/(Lmin),v(A)=0.2mol/(Lmin);
D、v(A)=0.2mol/(Lmin);
所以表示该化学反应的反应速率最大的是A。答案选A。


科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D的原子序数依次增大。X、Y、Z、W分别是由这四种元素中的两种组成的常见化合物,Y为淡黄色固体,W为常见液体;甲为单质,乙为红棕色气体;上述物质之间的转化关系如图所示(部分生成物已省略)。则下列说法中正确的是
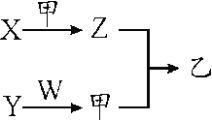
A. 沸点:W>X
B. 原子半径:D>C>B>A
C. C、D两种元素组成的化合物只含有离子键
D. A、B、C三种元素组成的化合物均为共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活息息相关。下列说法正确的是
A.矿泉水中不含任何化学物质B.聚乙烯不能使酸性高锰酸钾溶液褪色
C.碳酸钡可用作医疗上的“钡餐”D.氢氧化钠可用作治疗胃酸过多的药物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. CH3CH2CH(CH3)CH3的名称为3一甲基丁烷
B. CH3CH2CH2CH2CH3和CH3CH2CH(CH3)CH3互为同素异形体
C. ![]() 和
和![]() 为同一物质
为同一物质
D. CH3CH2OH和CH2OHCHOHCH2OH具有相同的官能团,互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
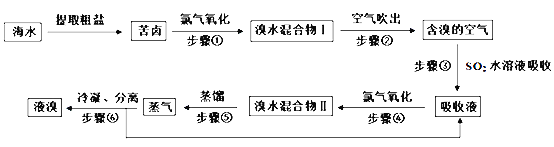
(1)步骤①获得Br2的离子反应方程式为:_________________________。
(2)步骤③所发生反应的化学方程式为:_________________________。在该反应中,氧化剂是______________(填化学式);若反应中生成2molHBr,则转移电子数约为_____________个。
(3)根据上述反应可判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是:_______________。
(4)步骤②通入热空气或水蒸气吹出Br2,利用了溴的________。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(5)提取溴单质时,蒸馏溴水混合物Ⅱ而不是蒸馏溴水混合物Ⅰ,请说明原因:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋氯芬酸(J)是一种新型、强效解热、镇痛、抗关节炎药物,其合成路线如下图所示(部分反应条件省略):
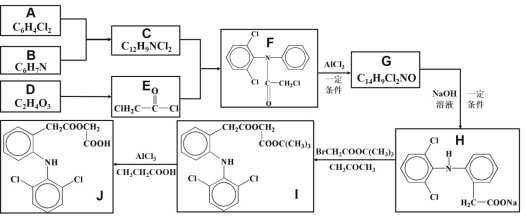
已知:①![]()
②![]()
③![]()
请回答:
(1)化合物D的名称为__________________;
(2)化合物F的分子式为________________;
(3)写出![]() 的方程式____________________________________________;
的方程式____________________________________________;
(4)![]() 的反应类型为_________________;
的反应类型为_________________;
(5)下列关于物质性质说法不正确的是_____________
A.化合物D可以发生氧化、取代、缩聚反应
B.化合物B具有碱性
C.化合物C中所有原子均可分布在同一平面
D.醋氯芬酸(J)在Ni的催化作用下与H2加成,最多可消耗8molH2
(6)已知C的同分异构体有多种,写出同时满足下列条件的同分异构体____________;(要求写出其中三种)
① 红外光谱表征分子中含有两个苯环结构 ②核磁共振氢谱显示只有5种不同环境的氢原子
(7)以苯和乙烯为原料,利用题目所给信息,写出合成 ![]() 的路线(用流程图表示,无机试剂任选)________________
的路线(用流程图表示,无机试剂任选)________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe和Fe2O3的混合物共13.6g,加入150mL稀H2SO4,在标准状况下收集到1.12LH2,Fe和Fe2O3均无剩余。为中和过量的H2SO4,并使Fe元素全部转化为Fe(OH)2沉淀,消耗了200mL 3mol/L的NaOH溶液,则该H2SO4的物质的量浓度为
A. 2.25mol/L B. 2mol/L C. 4mol/L D. 0.6mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组向某2L密闭容器中加入一定量的固体A和气体B,发生反应A(s)+2B(g)![]() D(g)+E(g);△H=Q kJ·mol-1。
D(g)+E(g);△H=Q kJ·mol-1。
(1)对于该反应,用各物质的反应速率与时间的关系曲线表示如下,示意图中的___________(填序号)正确。
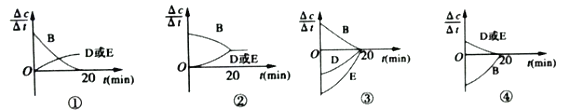
(2)若该密闭容器绝热,实验测得B的转化率随温度变化如右图所示。由图可知,Q_________0(填“大于”或“小于),c点v正__________v逆(填“大于”、“小于”或“等于”)。
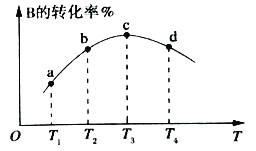
(3)在T℃时,反应进行到不同时间测得各物质的物质的量如表:
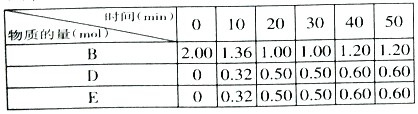
①T℃时,该反应的平衡常数K=___________。
②30min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是___________(填字母编号)。
a.通入一定量的B b.加入一定量的固体A c.适当缩小容器的体积 d.升高反应体系温度
③同时加入0.2mol B、0.1molD、0.1mol E后,其他反应条件不变,该反应平衡________移动。(填“向右”、“不”、“向左”)
④维持容器的体积和温度T℃不变,若向该容器中加入1.60molB、0.20molD、0.20molE和0.4molA,达到平衡后,混合气体中B的物质的量分数是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D四种短周期元素的原子半径依次减小,D能分别与A,B,C形成电子总数相等的分子X、Y、Z。C原子的最外层电子排布为nsnnp2n。E的原子序数为29。
(1)A,B,C的第一电离能由小到大的顺序为________(用元素符号表示)。
(2)X是含有________键(填“非极性”或“极性”,下同)的________分子。
(3)A的一种氢化物的相对分子质量为26,其分子中的σ键与π键的键数之比为________。
(4)Y分子的空间构型为__________,其中心原子采取________杂化。
(5)一种由B,C组成的化合物与AC2互为等电子体,其化学式为________。
(6)Y是一种易液化的气体,请简述其易液化的原因_________。
(7)写出E2+的电子排布式___________________,并写出E2+在Z中通入足量Y得到深蓝色溶液的离子反应方程式_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com