
【题目】某研究小组向某2L密闭容器中加入一定量的固体A和气体B,发生反应A(s)+2B(g)![]() D(g)+E(g);△H=Q kJ·mol-1。
D(g)+E(g);△H=Q kJ·mol-1。
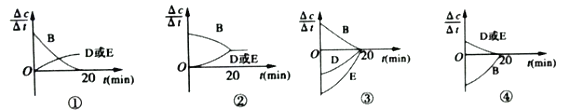
(1)对于该反应,用各物质的反应速率与时间的关系曲线表示如下,示意图中的___________(填序号)正确。
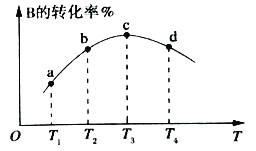
(2)若该密闭容器绝热,实验测得B的转化率随温度变化如右图所示。由图可知,Q_________0(填“大于”或“小于),c点v正__________v逆(填“大于”、“小于”或“等于”)。
(3)在T℃时,反应进行到不同时间测得各物质的物质的量如表:
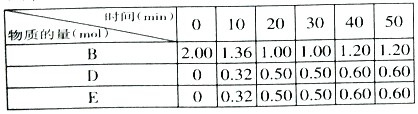
①T℃时,该反应的平衡常数K=___________。
②30min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是___________(填字母编号)。
a.通入一定量的B b.加入一定量的固体A c.适当缩小容器的体积 d.升高反应体系温度
③同时加入0.2mol B、0.1molD、0.1mol E后,其他反应条件不变,该反应平衡________移动。(填“向右”、“不”、“向左”)
④维持容器的体积和温度T℃不变,若向该容器中加入1.60molB、0.20molD、0.20molE和0.4molA,达到平衡后,混合气体中B的物质的量分数是___________。
【答案】④ 小于 等于 0.25 a 不 50![]()
【解析】
(1)依据速率和计量数关系及反应物和生成物速率增减相反,可逆反应不能进行到底,速率不能为零等解答;
(2)最高点达平衡状态,温度升高B的转化率减小,所以正反应是放热反应;
(3)①依据表中数据和平衡常数公式计算;
②由表数据可知30min后反应体系反应物和生成物的物质的量都增加,可能增大反应物B的量,平衡正向移动,导致反应物和生成的物质的量都增加,或按变化量同时改变反应物和生成物;
③该反应为前后气体物质的量不变的反应,按计量数之比改变物质的量平衡不移动;
④温度不变,平衡常数不变,依次计算B的体积分数。
(1)A(s)+2B(g)D(g)+E(g) △H=QkJ·mol-1,反应是前后气体体积不变的可逆反应;
①B的反应速率不能为0;故①错误;
②B的反应速率和D、E反应速率达到平衡状态不能相同;故②错误;
③D、E变化速率相同,与图象不符;故③错误;
④D、E速率相同,图象表示的是逆向进行,B反应速率增大,D、E反应速率减小,故④正确;
本题答案为:④。
(2)B的转化率最大即最高点达平衡状态,温度升高B的转化率减小,所以正反应是放热反应,即Q小于0,c点处于平衡状态所以v正=v逆;
本题答案为:小于;等于。
(3)①由表可知20分钟达平衡状态,结合平衡浓度和平衡常数概念计算,所以K=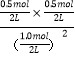 =0.25;
=0.25;
本题答案为:0.25。
②由表数据可知30min后反应体系反应物和生成物的物质的量都增加,可能增大反应物B的量,平衡正向移动,导致反应物和生成的物质的量都增加,或按变化量关系同时改变反应物和生成物的量;
a.通入一定量的B平衡正向进行,B、D、E增大,故a符合;
b.加入一定量的固体A不影响平衡移动,B、D、E不变,故b不符合;
c.反应前后气体体积不变,适当缩小容器的体积,平衡不移动,故c不符合;
d.反应是吸热反应,升高反应体系温度,平衡正向进行,B减小,故d不符合;
本题答案为:a。
③该反应为前后气体物质的量不变的反应,按计量数之比改变物质的量平衡不移动;
本题答案为:不。
④温度不变,平衡常数不变,设达到平衡时A的物质的量变化为xmol,
A(s)+2B(g)![]() D(g)+E(g)
D(g)+E(g)
起始 0.4 1.6 0.2 0.2
变化 x 2x x x
平衡0.4-x 1.6-2x 0.2+x 0.2+x 则K=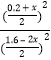 =0.25 解得:x=0.3mol,B、D、E的平衡是物质的量分别是:1mol 、0.5mol、0.5mol,故B的体积分数为1/2
=0.25 解得:x=0.3mol,B、D、E的平衡是物质的量分别是:1mol 、0.5mol、0.5mol,故B的体积分数为1/2![]() 100
100![]() =50
=50![]() ;
;
本题答案为:50![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】恒温恒容下,向2L密闭容器中加入MgSO4和CO(g),发生反应:
MgSO4(s)+CO(g)![]() MgO(s)+CO2(g)+SO2(g),反应过程中测定的部分数据见下表:
MgO(s)+CO2(g)+SO2(g),反应过程中测定的部分数据见下表:
反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(CO2)/mol |
0 | 2.00 | 2.00 | 0 |
2 | 0.80 | ||
4 | 1.20 |
下列说法正确的是
A. 反应在0~2min内的平均速率为v(SO2)=0.6mol·L-1·min-1
B. 反应在2~4min内容器内气体的密度没有变化
C. 若升高温度,反应的平衡常数变为1.00,则正反应为放热反应
D. 保持其他条件不变,起始时向容器中充入1.00molMgSO4和1.00molCO,到达平衡时n(CO2)>0.60mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同情况下测得A(g)+3B(g)![]() 2C(g)+2D(g)的下列反应速率,其中反应速率最大的是
2C(g)+2D(g)的下列反应速率,其中反应速率最大的是
A. υ(D)=0.01 molL-1s-1 B. υ(C)=0.5 molL-1min-1
C. υ(B)=0.6 molL-1min-1 D. υ(A)=0.2molL-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH<0。在其他条件一定,只改变某一条件时,下列分析不正确的是
2SO3(g) ΔH<0。在其他条件一定,只改变某一条件时,下列分析不正确的是

A. 图Ⅰ表示的是t1时刻增大压强对反应速率的影响
B. 图Ⅱ表示的是t1时刻加入催化剂对反应速率的影响
C. 图Ⅲ表示的是温度对平衡的影响,且甲的温度小于乙的温度
D. 图Ⅲ表示的是催化剂对化学平衡的影响,乙使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是
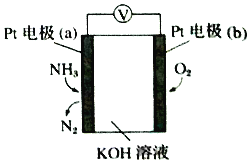
A. O2在电极b上发生还原反应
B. 溶液中OH-向电极a移动
C. 正极的电极反应式为O2+4e-+4H+=2H2O
D. 负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期中的18种元素具有重要的用途,在现代工业中备受青睐。
(1)钛原子的价电子排布式为______________________,TiCl4沸点136℃,熔点-25℃,晶体类型为___________晶体。
(2)铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是______________________。
(3)与As同主族的短周期元素是N、P。AsH3中心原子轨道杂化的类型_________________;一定压强下将AsH3、NH3和PH3的混合气体降温时液化顺序是______________________,理由是______________________。
(4)铬是一种硬而脆抗腐蚀性强的金属,常用于电镀和制造特种钢。下图1为铬的晶胞结构图,则铬晶胞属于___________堆积;该晶胞中原子的体积占晶胞体积的百分率为___________。

(5)钴晶体的一种晶胞(如图2所示)的边长为anm,密度为ρg·cm-3,NA表示阿伏加德罗常数的值,则钴原子半径为___________mm,钴的相对原子质量可表示为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.如图所示为常见玻璃仪器的部分结构:
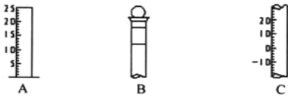
(1)请写出所列仪器的名称:A__________,B____________;C_____________;
(2)仪器 B 使用前必须______________________。
(3)仪器 B 上标记有__________________(填序号);
①质量 ②温度 ③刻度线 ④浓度 ⑤容积
II. 某无色工业废水中可能含有Na+、Mg2+、Al3+、Cl-、SO42-中的几种离子。
a.取少许该废水于试管中,加入足量的Ba(NO3)2溶液和稀硝酸,产生白色沉淀,充分反应后过滤,向滤液中加入AgNO3溶液无沉淀产生。
b.另取10mL该废水于试管中,滴加NaOH溶液先产生白色沉淀,后部分沉淀溶解。生成沉淀的物质的量随加入NaOH的物质的量关系如下图所示。
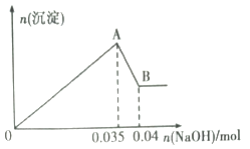
根据上述实验和图中数据:
(1)该废水中一定不含有的离子有________________(填离子符号);
(2)写出A→B过程中发生反应的离子方程式:_________________;
(3)该废水中,c(Al3+)=________________________;
(4)①实验室配制100mL2mol/L的NaOH溶液时,用到的玻璃仪器除烧杯、玻璃棒、量筒外,还需要________(填仪器名称)。
②下列操作使所配溶液浓度偏大的是(填写字母)________。
A.称量用了生锈的砝码
B.将NaOH放在纸张上称量
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中
D.往容量瓶转移时,有少量液体贱出
E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 56 g Fe 与1mol Cl2充分反应,转移的电子数为3NA
B. 分子数为 0.1NA的CH4和NH3混合气体,含有的共用电子对数为0.4NA
C. 25℃时,1L pH=12的Ba(OH)2溶液中含有0.02NA 的OH-
D. 常温常压下,22 g D3O+中含有10NA个电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com