
| A. | Z的电子式为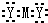 | B. | Z可表示为M2Y | C. | Z一定溶于水中 | D. | M形成+2价阳离子 |
分析 由题意可知,一个M原子失去2个电子形成M2+,故M的最外层电子数应为2个,金属元素,一个Y原子得到1个电子形成Y-,说明是非金属,且Z属于离子化合物,化学式为MY2,据此解答.
解答 解:A.由题意可知,一个M原子失去2个电子形成M2+,故M的最外层电子数应为2个,金属元素,一个Y原子得到1个电子形成Y-,说明是非金属,且Z属于离子化合物,电子式为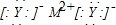 ,故A错误;
,故A错误;
B.Z的化学式为MY2,故B错误;
C.不能确定Z的具体物质,则Z不一定溶于水中,故C错误;
D.一个M原子失去2个电子形成M2+,故D正确;
故选D.
点评 本题考查原子结构与元素性质,难度不大,通过电子的得失确定元素的化合价是关键,注意电子式的书写,侧重于考查学生的分析能力和对基础知识的应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
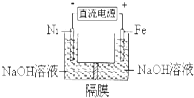
| A. | 铁是阳极,电极反应为Fe-6e-+4H2O═FeO42-+8H+ | |
| B. | 若隔膜为阴离子交换膜,则OH-自左向右移动 | |
| C. | 电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极 | |
| D. | 每制得1mol Na2FeO4,理论上可以产生67.2L气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、+4、-2 | -2 |
| A. | 沸点:H2T>H2R | |
| B. | 热稳定性:H2T<H2R | |
| C. | 与稀盐酸反应的剧烈程度:L单质<Q单质 | |
| D. | L2+与R2-的核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ③④②① | C. | ①②③④ | D. | ③④①② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com