
����Ŀ��������ڡ����ɵĻ�ѧ�ҡ�һ����˵�����ڻ�ĵ��������£����������е�ˮ����ɥʧ��ԭ�е���ɫ�����һ�ֺ�ɫ���ʣ�������ʹ���κθ����Լ��������ֺ�ɫ����Ҳ���Եõ��������ù��̿ɱ�ʾΪ��![]() ������˵���������
������˵���������
A. ������������ı仯����������ԭ��Ӧ B. �˷�Ӧ�ɴ��Բⶨ�����������ĺ���
C. ������������ı仯��һ������Ļ�ѧ��Ӧ D. ���ȷֽⷨ�����������Ƶõ��ʹ�
 ����ʦ��Сһ����ʦ������ҵϵ�д�
����ʦ��Сһ����ʦ������ҵϵ�д� ���100�ֵ�Ԫ�Ż�������ϵ�д�
���100�ֵ�Ԫ�Ż�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ��������������(CH3CH2CH2CH3)���������ѽⷴӦ��
����CH3CH2CH2CH3 (g)![]() CH3CH=CH2(g)+CH4(g) ��H1=+ 61.31 kJ��mol-1
CH3CH=CH2(g)+CH4(g) ��H1=+ 61.31 kJ��mol-1
����CH3CH2CH2CH3(g)![]() CH2=CH2(g)+CH3CH3(g) ��H2=-56.00 kJ��mol-1
CH2=CH2(g)+CH3CH3(g) ��H2=-56.00 kJ��mol-1
��1��ά����ϵ�¶�T���䣬��ѹp�㶨ʱ�����ΪV1 L�������鷢���ѽⷴӦ��һ��ʱ��ƽ������������ΪV2 L����ʱ�������ת����a(������)=________��ά����ϵ�¶Ȳ��䣬����ϵ�г���һ������ˮ����(ˮ�����ڸ������²����뷴Ӧ)���ٴ�ƽ����������ת���ʽ�________(��������������������������С��)��ԭ��Ϊ____________________________________________________��
��2��һ���¶��������Ϊ2L���ܱ������г���0.2molCH3CH=CH2��0.5 molCH4������ӦCH3CH=CH2(g) +CH4(g)![]() CH2=CH2(g)+CH3CH3(g) ��H3��5 min��ﵽƽ��״̬��������ʣ��CH3CH =CH2�����ʵ���Ϊ0.1mol��
CH2=CH2(g)+CH3CH3(g) ��H3��5 min��ﵽƽ��״̬��������ʣ��CH3CH =CH2�����ʵ���Ϊ0.1mol��
�١�H3=________��
��5min�ڸ÷�Ӧ�ķ�Ӧ����v(CH4)=________��
�������¶Ȳ�������ij�ܱ������г�������ʵ�����CH3CH =CH2��CH4��ƽ���������CH4���������Ϊ________��
��3����0.1molCH2=CH2��ȫȼ�պ������ͨ��100mLһ��Ũ�ȵ�NaOH��Һ�У�����������Һϡ����1L������������Һ��CO32-��HCO3-��H2CO3 ������ռ���ʵ���������ԭNaOH��ҺŨ�ȱ仯�Ĺ�ϵ��ͼ��ʾ��
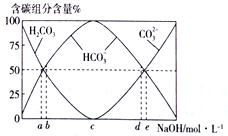
����ͼ�б�ʾԭ����������ҺŨ��Ϊ3mol��L-1����________(ѡ����a������b������c������d������e�� )��
��4��������������ҺΪ�������Һ��CH2=CH2 ȼ�ϵ�صĸ�����ӦʽΪ_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȩ(HCHO)�����������ƾ��л�ԭ�ԡ�Ϊ̽��������ȩ������Cu(OH)2��Ӧ�IJ�����������о���
(1)����ͼװ���н���ʵ�飬��a�м���0.5 mol��L-1CuSO4��Һ50 mL��5 mol��L-1NaOH��Һ100 mL�����ټ���40���ļ�ȩ��Һ50 mL����������a 20���Ӻ���ȴ�����¡�
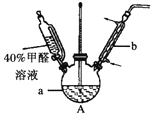
������b��������_________��
����˵����ȩ���л�ԭ�Ե�ʵ��������_________________��
(2)����ʵ���и���Ӧ����������������ΪCO��H2�е�һ�ֻ����֡�Ϊȷ������ɷ֣���װ��A������ͼ��ʾװ�����Ӻ����ʵ�顣
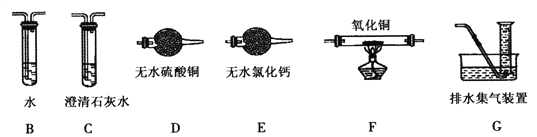
�������ӵĺ���˳��ΪA��B��___��____��____��____��G��װ��B��������_____________����H2��ʵ��������_________________________��
(3)��֪��![]() ���ʵ��֤��a�м�ȩ�е�̼Ԫ��δ��������+4�ۡ�д��ʵ�������������______________________��
���ʵ��֤��a�м�ȩ�е�̼Ԫ��δ��������+4�ۡ�д��ʵ�������������______________________��
(4)��Ӧ��a���к�ɫ���������Ϊ�о�����ɣ���������ʵ��(����ÿ������ַ�Ӧ)��
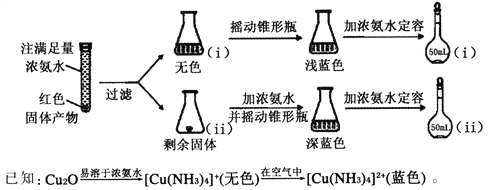
����ƿii�й�����ȫ�ܽ������ɫ��Һ�����ӷ���ʽΪ____________________��
�ڽ�����ƿii�е���Һϡ��100������Һ����ɫ������ƿi������ɴ˿�֪����������ɼ����ʵ���֮��ԼΪ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ĸ�װ�õ�˵������ʵ��Ҫ�����
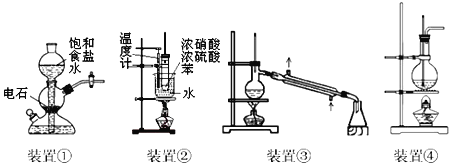
A. װ�â٣�ʵ�����������Ʊ��϶�������Ȳ���ô�װ��
B. װ�âڣ�ʵ�����п��ô�װ�����Ʊ�������.
C. װ�âۣ�ʵ�����п��ô�װ�������뺬������Ȼ�̼Һ�壬��������ƿ�пɻ�õ�
D. װ�âܣ�ʵ�����п��ô�װ�����Ʊ���������������ƿ�л�ò���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Cl2��һ����Ҫ�Ļ���ԭ�ϣ� ����������ز�Ʒ������������Ӧ�ù㷺��������������֪ʶ����������⣻
��1�����������������䲻���㣬��ҵ�ϳ�������ת��ΪƯ�ۣ���ҵ������Ư�۵���Ҫ��ѧ����ʽ��______________________��Ư�۵���Ч�ɷ��ǣ��ѧʽ��_________��Ư���ڿ����г��ڴ�Ż���ʶ�ʧЧ��ԭ���ǣ��û�ѧ����ʽ˵���� _____________��
��2��ʵ���ҿ��ö������̺�Ũ���ᷴӦ��ȡ��������Ӧ�Ļ�ѧ����ʽ�� MnO2+4HCl(Ũ) ![]() MnCl2+Cl2��+2H2O ���������ж�����ʵ����ͨ����___________________��Һ����β�����ѧʽ������Ӧ�Ļ�ѧ����ʽΪ_____________________��
MnCl2+Cl2��+2H2O ���������ж�����ʵ����ͨ����___________________��Һ����β�����ѧʽ������Ӧ�Ļ�ѧ����ʽΪ_____________________��
��3��������һ�ֳ��õ���������������ˮ�������������ֳ���ͬ������(�û�ѧʽ�����ӷ�����д)��
ʹ��ˮ�ʻ���ɫ����________����ʹAgNO3��Һ������ɫ��������________����ʹ��ɫʯ����Һ�Ժ�ɫ����________����ʹ��ֽ��ɫ����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Լ���ơ������Լ���������±���������þ����ˮ���������õõ��ģ��������ʻ������ӳɷ�Ӧ���磺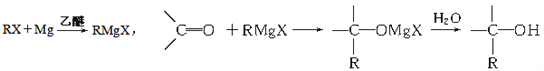
����ͨ��������Ӧ�ϳ�2-������ѡ�õ��л�ԭ����ȷ��һ����
A. ������ͼ�ȩ B. ������ͱ�ȩ
C. һ�ȼ���ͱ�ͪ D. һ�ȼ������ȩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ɳĮ���������������ں�ˮ�е����㣬������ǵĻ�ѧԪ������
A. ������ͬ B. ����ϴ�
C. ����ȷ�� D. û��һ���ı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������Cl2��ӦΪ4HCl(Ũ)��MnO2![]() MnCl2��Cl2����2H2O����˵������ȷ����
MnCl2��Cl2����2H2O����˵������ȷ����
A. ��ԭ����HCl����������MnO2
B. ÿ����1 mol Cl2��ת�Ƶĵ�����Ϊ2 NA
C. ת�Ƶ��ӵ����ʵ���Ϊ1 molʱ�����ɱ�״����Cl2�����Ϊ11.2 L
D. ÿ����1 mol MnO2����ԭ�����õ�HCl����4 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�������ŷŵĹ�ҵ��ˮ����Ҫ��Na+��HSO3����SO42-���о�С�����ⶨ����HSO3����Ũ�ȣ������������������
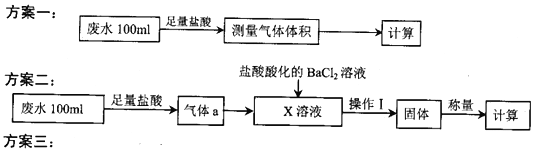
��ȡ20.00mL��ˮ��������0.02moL��K-1MnO4����Һ���еζ�����¼���ݣ����㡣
�ش���������
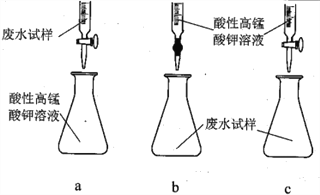
��1��������ͼ��ʾ��װ����ɷ���һ
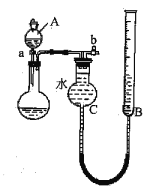
������A��������______________��
�ڶ���ǰ��Ӧ���еIJ�����____________________________��
�۸÷������ڽϴ�������ܵ�һ��ԭ����____________________________��
��2���ٷ���������������a����X��Һ��������______________ (����)��
a.Na2SO3��Һ b.˫��ˮ c.��������Һ d.H2SO4�ữ��KMnO4��Һ
������Ϊ�������ƣ�д������a��X��Һ��Ӧ�����ӷ���ʽ____________________________��
�۸÷����У�����I�����IJ�����������Ϊ______________��
��3���ٷ�������Ƶ����еζ���ʽ�У����������______________ (����)���÷����Ƿ���Ҫָʾ��? ______________ (����������������)��ԭ����__________________________________________��
�ڵζ���¼�������±���
�ζ�ǰ����/mL | �ζ������/mL | |
��һ�� | 0.10 | 16.12 |
�ڶ��� | 1.10 | 17.08 |
������ | 1.45 | 21.45 |
���Ĵ� | 0.00 | 16.00 |
����÷�ˮ������HSO3����Ũ��Ϊ______________ mol ��L-l��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com