镁是海水中含量较多的金属,镁、镁合金及其镁的化合物在科学研究和工业生产中用途非常广泛.
(1)Mg
2Ni是一种储氢合金,已知:
Mg(s)+H
2(g)=MgH
2(s)△H
1=-74.5kJ?mol
-1Mg
2Ni(s)+2H
2(g)=Mg
2NiH
4(s)△H
2=-64.4kJ?mol
-1Mg
2Ni(s)+2MgH
2(s)=2Mg(s)+Mg
2NiH
4(s)△H
3则△H
3=
kJ?mol
-1.
(2)工业上可用电解熔融的无水氯化镁获得镁.其中氯化镁脱水是关键工艺之一,一种正在试验的氯化镁晶体脱水的方法是:先将MgCl
2?6H
2O转化为MgCl
2?NH
4Cl?nNH
3(铵镁复盐),然后在700℃脱氨得到无水氯化镁,脱氨反应的化学方程式为
;电解熔融氯化镁,阴极的电极反应式为
.
(3)储氢材料Mg(AlH
4)
2在110-200°C的反应为:Mg(AlH
4)
2=MgH
2+2A1+3H
2↑每生成27gAl转移电子的物质的量为
.
(4)工业上用MgC
2O
4?2H
2O热分解制超细MgO,其热分解曲线如图.图中隔绝空气条件下B→C发生反应的化学方程式为
(5)一种有机镁化合物可用于制造光学元件的涂布液,化学式可表示为:

,它可发生如下反应:

ROH与B的核磁共振氢谱如图:
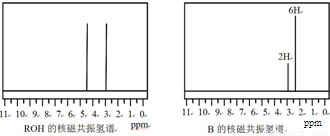
ROH由C、H、O、F四种元素组成的含氟有机物,分子中只有1个氧原子,所有氟原子化学环境相同,相对分子质量为168,则ROH的结构简式为
; B的结构简式为
.

 镁是海水中含量较多的金属,镁、镁合金及其镁的化合物在科学研究和工业生产中用途非常广泛.
镁是海水中含量较多的金属,镁、镁合金及其镁的化合物在科学研究和工业生产中用途非常广泛. ,它可发生如下反应:
,它可发生如下反应:

 ,
, .
.

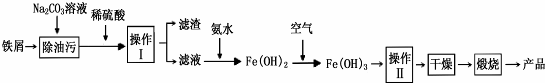
 Na、Fe、Cu、Al是常见的金属元素,请按要求回答下列问题:
Na、Fe、Cu、Al是常见的金属元素,请按要求回答下列问题: