
| 1000��w |
| M |
| 1000��1.5��60% |
| 98 |
| 448mL��10-3L/mL |
| 22.4L/mol |
| 1 |
| 2 |
| 1 |
| 2 |


 �߲������Ӧ��һ��ͨϵ�д�
�߲������Ӧ��һ��ͨϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������������ȼ������Al2O3������˿��������ȼ������Fe2O3 |
| B�����ܴ�����ͭ��Һ���û���ͭ������Ҳ�ܴ�����ͭ��Һ���û���ͭ |
| C�����ý����Ʊ�����ú���У��ʻ��ý�����Ҳ������ú���� |
| D������������ˮ�ȷ�Ӧʱ�ƾ�����ԭ�����ʽ������ʲ��뷴Ӧʱ����������ԭ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��CuCl2 |
| B��FeCl2 |
| C��FeCl3 |
| D��MgCl2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
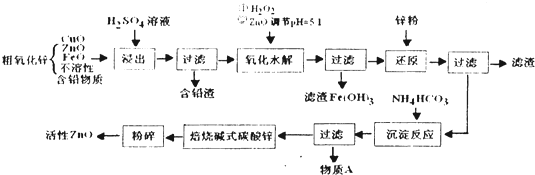
 þ�Ǻ�ˮ�к����϶�Ľ�����þ��þ�Ͻ���þ�Ļ������ڿ�ѧ�о���ҵ��������;�dz��㷺��
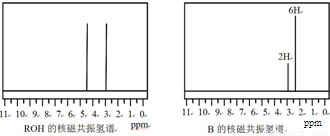
þ�Ǻ�ˮ�к����϶�Ľ�����þ��þ�Ͻ���þ�Ļ������ڿ�ѧ�о���ҵ��������;�dz��㷺�� �����ɷ������·�Ӧ��
�����ɷ������·�Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
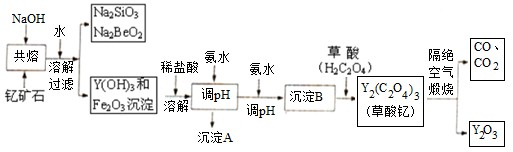
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �������仯������������������з�������Ҫ�����ã�
�������仯������������������з�������Ҫ�����ã��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ���� | ��ʼ����ʱ��pH | ��ȫ����ʱ��pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ݢڢܢ٢� |
| B���ܢڢݢ٢� |
| C���ݢܢڢ٢� |
| D���ڢܢݢۢ� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com