

| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
| ||
| ||


科目:高中化学 来源: 题型:
 Na、Fe、Cu、Al是常见的金属元素,请按要求回答下列问题:
Na、Fe、Cu、Al是常见的金属元素,请按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
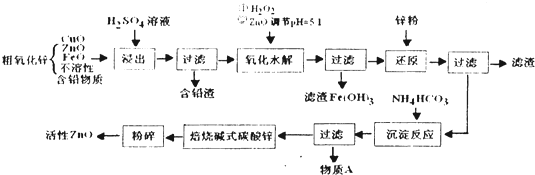
查看答案和解析>>
科目:高中化学 来源: 题型:
A、b<
| ||
B、b<
| ||
C、b>
| ||
D、b>
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、14.4 g?L-1 |
| B、8 g?L-1 |
| C、5.6 g?L-1 |
| D、7.2 g?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、硫磺矿制备硫酸经历两步:S
| ||||
| B、酸雨与土壤中的金属氧化物反应后,硫元素以单质的形式进入土壤中高温 | ||||
C、在燃煤中加入石灰石可减少SO2排放,发生的反应为:2CaCO3+2SO2+O2
| ||||
| D、土壤中的闪锌矿(ZnS)遇到硫酸铜溶液转化为铜蓝(CuS),说明CuS很稳定,不具有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
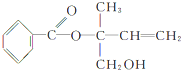
| A、X的分子式为C12H16O3 |
| B、X在一定条件下能发生加成、加聚、取代、消去等反应 |
| C、在Ni作催化剂的条件下,1mol X最多只能与1mol H2加成 |
| D、可用酸性高锰酸钾溶液区分苯和X |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com