
 Na、Fe、Cu、Al是常见的金属元素,请按要求回答下列问题:
Na、Fe、Cu、Al是常见的金属元素,请按要求回答下列问题:
| ||


科目:高中化学 来源: 题型:
| A、向硫代硫酸钠溶液中滴加稀硫酸会产生淡黄色沉淀和刺激性气味气体 |
| B、配制硫酸亚铁溶液时应加入适量稀盐酸防止Fe2+水解 |
| C、在船舶外壳上装锌块应用的是外加电流的阴极保护法 |
| D、测定中和热的实验中使用环形玻璃搅拌棒是为了减少热量的损失 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所有的金属都是固态的 |
| B、活泼的金属、或较活泼的金属能与酸反应,但不能与碱反应 |
| C、金属元素在自然界中都是以化合态存在的 |
| D、金属具有导电性、导热性和延展性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 金属及其化合物在人类生活、生产中发挥着重要的作用.
金属及其化合物在人类生活、生产中发挥着重要的作用.查看答案和解析>>
科目:高中化学 来源: 题型:
 镁是海水中含量较多的金属,镁、镁合金及其镁的化合物在科学研究和工业生产中用途非常广泛.
镁是海水中含量较多的金属,镁、镁合金及其镁的化合物在科学研究和工业生产中用途非常广泛. ,它可发生如下反应:
,它可发生如下反应:
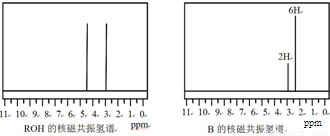
查看答案和解析>>
科目:高中化学 来源: 题型:
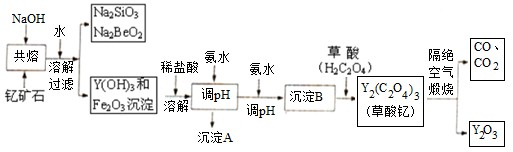
查看答案和解析>>
科目:高中化学 来源: 题型:

| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③⑤④ |
| B、①②③④⑤ |
| C、④⑤①②③ |
| D、③②①④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com