
【题目】(1)按如图所示操作,充分反应后:
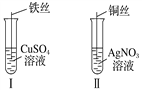
①Ⅰ中铁丝上观察到的现象是______________________;
②Ⅱ中发生反应的离子方程式为_______________________;
③结合Ⅰ、Ⅱ实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为_____________。
(2)在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴FeCl3溶液,继续煮沸至溶液呈红褐色,停止加热。
①写出制备氢氧化铁胶体的化学方程式____________________.
②向氢氧化铁胶体中逐滴滴入过量盐酸,出现的实验现象为:___________________________
【答案】 铁丝上析出了红色固体 Cu + 2Ag+= 2Ag + Cu2+ Ag+> Cu2+>Fe2+ FeCl3+3H2O ![]() Fe(OH)3(胶体)+3HCl 先出现红褐色沉淀,之后沉淀又逐渐溶解
Fe(OH)3(胶体)+3HCl 先出现红褐色沉淀,之后沉淀又逐渐溶解
【解析】试题分析:本题考查离子方程式的书写,氧化性强弱的比较,氢氧化铁胶体的制备和性质。
(1)①Fe丝插入CuSO4溶液中,发生置换反应:Fe+CuSO4=FeSO4+Cu,反应的离子方程式为:Fe+Cu2+=Fe2++Cu,铁丝上观察到的现象是:铁丝上析出红色固体。
②铜丝插入AgNO3溶液中,发生置换反应:Cu+2AgNO3=Cu(NO3)2+2Ag,反应的离子方程式为:Cu+2Ag+=Cu2++2Ag。
③根据同一个氧化还原反应中,氧化性:氧化剂![]() 氧化产物。由反应Fe+Cu2+=Fe2++Cu得出氧化性:Cu2+
氧化产物。由反应Fe+Cu2+=Fe2++Cu得出氧化性:Cu2+![]() Fe2+;由反应Cu+2Ag+=Cu2++2Ag得出氧化性:Ag+
Fe2+;由反应Cu+2Ag+=Cu2++2Ag得出氧化性:Ag+![]() Cu2+,则Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为Ag+
Cu2+,则Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为Ag+![]() Cu2+
Cu2+![]() Fe2+。
Fe2+。
(2)①制备氢氧化铁胶体的化学方程式为:FeCl3+3H2O ![]() Fe(OH)3(胶体)+3HCl。
Fe(OH)3(胶体)+3HCl。
②盐酸属于电解质溶液,在氢氧化铁胶体中加入盐酸,盐酸使氢氧化铁胶体发生聚沉,观察到产生红褐色沉淀,继续加盐酸,发生反应Fe(OH)3+3HCl=FeCl3+3H2O,沉淀逐渐溶解。所以向氢氧化铁胶体中逐滴滴入过量盐酸,出现的实验现象是:先出现红褐色沉淀,之后沉淀又逐渐溶解。


科目:高中化学 来源: 题型:
【题目】过氧化钠跟足量的NaHCO3混合后,在密闭容器中充分加热,排除气体物质后冷却残留的固体物质是
A. Na2O2、Na2CO3 B. NaOH、Na2CO3
C. Na2CO3 D. Na2O2、NaOH、Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.在常温常压下,1 mol氦气含有的原子数为NA
B.标准状况下,5.6 L四氯化碳含有的分子数为0.25NA
C.常温常压下,氧气和臭氧(O3)的混合物32 g中含有NA个氧原子
D.物质的量浓度为1 mol·L-1的K2SO4溶液中,含2 NA个K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜的配合物A(结构如图)。请回答下列问题:
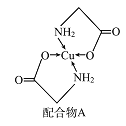


(1)Cu的简化电子排布式为______________ 。
(2)A所含三种元素C、N、O的第一电离能由大到小的顺序为_______________。其中氮原子的杂化轨道类型为________。
(3)配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2,N2中σ键和π键数目之比
是__________;N2O与CO2互为等电子体,且N2O分子中O只与一个N相连,则N2O的电子式为_______。
(4)在Cu催化下,甲醇可被氧化为甲醛(HCHO),甲醛分子中H CO的键角___________(选填“大于”、“等于”或“小于”)120°;甲醛能与水形成氢键,请在右图中表示出来___________。
(5)立方氮化硼(如图)与金刚石结构相似,是超硬材料。立方氮化硼晶体内B-N键数与硼原子数之比为___________;结构化学上用原子坐标参数表示晶胞内部各原子的相对位置,上图(右)立方氮化硼的晶胞中,B原子的坐标参数分别有:
![]() 等。则距离上述三个B原子最近且等距的N原子的坐标参数为____________________ 。
等。则距离上述三个B原子最近且等距的N原子的坐标参数为____________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【哈尔滨市第三中学2017届第三次模拟考试】可逆反应NO2(g)+ CO(g) ![]() CO2(g)+ NO(g) 反应过 程中的能量变化如图所示,下列说法正确的是
CO2(g)+ NO(g) 反应过 程中的能量变化如图所示,下列说法正确的是

A.1molNO2与1molCO混合经充分反应放热234 kJ
B.若反应开始时加入催化剂, 则使E1 、E2 都变大
C.正反应的活化能是134kJ/mol
D.该反应的反应热⊿H = E2–E1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识,回答下列问题:
(1)现有下列物质;①熔融的NaCl ②液态HCl ③蔗糖 ④汞 ⑤NaOH溶液 ⑥稀硫酸 ⑦CO2 ⑧KCl晶体
其中属于电解质的是__________;属于非电解质的是__________;能导电的有__________。
(2)按要求填空。
①NaHSO4溶液(写出电离方程式)____________________________。
②氯水与KI溶液反应(写出离子方程式)_____________________________。
③苏打和澄清石灰水反应(写出离子方程式)_______________________________
(3)配平下列氧化还原方程式:
①_____Fe+_____HNO3 = _____Fe(NO3)3+_____NO↑+_____H2O
②____CO+____ Fe2O3 ![]() ____Fe+_____CO2
____Fe+_____CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体积为1 mL、浓度均为0.10 mol/L的XOH和X2CO3溶液分别加水稀释至体积为V,pH随lgV的变化情况如图所示,下列叙述中正确的是

A. XOH是弱碱
B. pH=10的两种溶液中的c(X+):XOH大于X2CO3
C. 已知H2CO3的电离平衡常数Ka1远远大于Ka2,则Ka2约为1.0×10-10.2
D. 当lgV=2时,若X2CO3溶液升高温度,溶液碱性增强,则c(HCO3-)/c(CO32-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaNO2是一种食品添加剂,它能致癌。酸性 KMnO4溶液与 NaNO2。的反应方程式是MnO4-+NO2-+□→Mn2++NO3-+H2O。下列叙述中正确的是( )
A. 该反应中 NO2-被还原 B. 反应过程中溶液的pH 减小
C. 生成1 mol NaNO3需消耗 0.4mol KMnO4 D. □中的粒子是 OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com