
【题目】美国《Scinece》杂志曾报道科学家合成和分离出含高能正离子![]() 的化合物N5AsF6,有研究者预想合成一个纯粹由氮组成的新物种
的化合物N5AsF6,有研究者预想合成一个纯粹由氮组成的新物种 ![]() ,若
,若![]() 离子中每个氮原子均满足8电子结构,下列关于含氮微粒的表述正确的是
离子中每个氮原子均满足8电子结构,下列关于含氮微粒的表述正确的是
A. ![]() 中N原子间形成离子键B. N5AsF6中As的化合价为+1
中N原子间形成离子键B. N5AsF6中As的化合价为+1
C. ![]() 的摩尔质量为112D.
的摩尔质量为112D. ![]() 所含质子数为21
所含质子数为21
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】亚硝酰氯NOCl可用于合成清洁剂等。它可用Cl2与NO在常温常压下合成:它的熔点为-64.5℃,沸点为-5.5℃,常温下是黄色的有毒气体,遇水易水解。 请按要求回答下列相关问题:
(1)过量铁屑和稀硝酸充分反应制备NO的离子方程式为:______________________。
(2)制备NOCl的装置如下图所示,连接顺序为:a→_________________________(按气流自左向右方向,用小写字母表示)。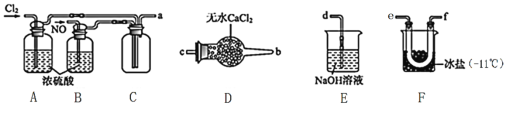
①装置A和B作用是①干燥NO和Cl2,②___________________________________________。
②装置D的作用是______________________________________。
③装置E中NOCl发生反应的化学方程式为________________。
(3)工业生产过程中NO尾气处理方法有多种,其中间接电化学法,其原理如图所示:
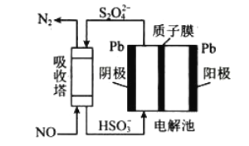
该过程中阴极的电极反应式为:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳铵是一种较常使用的化肥,它在常温下易分解。某化学兴趣小组对碳铵的成分存在疑问,进行了如下探究。
检验溶液中的阴、阳离子:取少量固体放入试管中,加入盐酸,把生成的气体通入澄清石灰水中,有白色沉淀生成。再另取少量碳铵放入试管中,加入浓NaOH溶液,加热,用湿润的红色石蕊试纸检验生成的气体,石蕊试纸变蓝色。
(1)根据实验现象,推测碳铵中所含有阴离子可能是____和_____;
(2)根据实验现象,碳铵与足量NaOH溶液加热反应的离子方程式可能是_____。
测定碳铵中C元素和N元素质量比。该兴趣小组准确称取ag碳铵,加热使之分解,并把产物通入碱石灰中,如图1所示。

(3)碳铵固体应放在____中进行加热。
A.试管 B.蒸发皿 C.烧瓶 D.坩埚
(4)从安全的角度考虑,尾气处理的装置可以选用如图2_____;
(5)若灼烧后没有固体残余,称量U形管在实验前后的质量差为bg。由此测得N元素的质量是____g。
(6)为了测定碳铵中碳元素的质量,他们设计的实验方案是将ag碳铵完全溶解于水,加入过量BaCl2,然后测定生成沉淀质量。请你评价该方案是否合理;_____(填“合理”“不合理”),理由是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《Journal of Energy Chemistry》杂志曾报道我国科学家设计的CO2熔盐捕获与转化装置,其示意图如图所示,下列有关说法正确的是
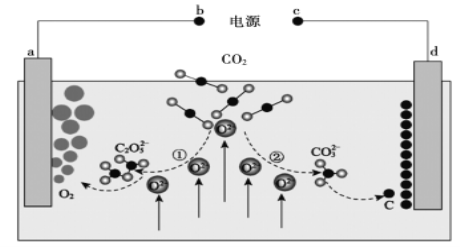
A. b为负极
B. ①②中,捕获CO2时碳元素的化合价发生了变化
C. a极电极反应式为![]()
D. 转移1mol电子可捕获CO2气体22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知17g H2R中含1mol H,则R的摩尔质量为__________。
(2)同温同压下,等体积的NH3气和H2S气的质量之比为__________。
(3)若由NH3和H2S组成的混合气体的平均相对分子质量为20.4,则混合气中NH3和H2S的分子数之比为__________。
(4)配制500mL 0.2mol/L Na2CO3溶液,需要用托盘天平称量![]() 晶体的质量为__________ g。
晶体的质量为__________ g。
(5)将a L标准状况下的氯化氢气体溶于100mL水中(水的密度近似为1g/mL),得到密度为ρ g/mL的盐酸,则该盐酸的物质的量浓度是____________________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 向明矾溶液中加入少量的氢氧化钡溶液:2Al3++![]() +3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓
+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓
B. 向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+=Fe2++2H2O
C. 向磷酸二氢铵溶液中加入足量的氢氧化钠溶液:![]() +OH-=NH3·H2O
+OH-=NH3·H2O
D. 含等物质的量的MgCl2、Ba(OH)2和HC1溶液混合:Mg2++2OH-=Mg(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物的转化过程如图所示,下列分析合理的是

A. 催化剂a表面发生了极性共价键的断裂和形成
B. 在催化剂b表面形成氮氧键时,不涉及电子转移
C. N2与H2反应生成NH3的原子利用率为100%
D. 催化剂a、b能提高反应的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验。

(1)向A、B溶液中分别滴入几滴KSCN溶液, A溶液颜色:________B溶液颜色_______。
(2)写出上述过程中有关反应的离子方程式:A→B___________________。若有2mol的A参与该反应,则转移______mol电子。A作_____剂
(3)B→C(暴露在空气中)可看到的现象是__________________________________。
(4)将A的饱和溶液制成胶体的操作______________________;当光束通过该胶体时,可看到一条光亮的“通路”,这种现象称为___________效应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个密闭容器中,中间有一可自由滑动的隔板,将容器分成两部分。当左边充入28克N2,右边充入8克CO和CO2的混合气体时,隔板处于如图所示位置(两侧温度相同)。下列说法正确的是

A.右边CO和CO2的分子数之比为1∶3
B.右边CO的质量为2.75克
C.若改变右边CO和CO2的充入量而使隔板处于距离右端1/6处,保持温度不变,则前后两次充入密闭容器内的气体总压强之比为25∶24
D.右侧气体密度是相同条件下氢气密度的32倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com