
【题目】《Journal of Energy Chemistry》杂志曾报道我国科学家设计的CO2熔盐捕获与转化装置,其示意图如图所示,下列有关说法正确的是
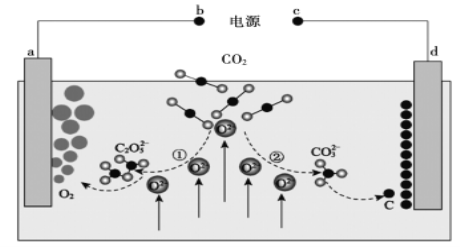
A. b为负极
B. ①②中,捕获CO2时碳元素的化合价发生了变化
C. a极电极反应式为![]()
D. 转移1mol电子可捕获CO2气体22.4L
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的五种短周期元素,其中C为第三周期简单离子半径最小的元素,0.1mol·L1A、B、D的最高价氧化物对应的水化物溶液加水稀释时溶液的pH变化情况如图,则下列说法中不正确的是

A. C制的容器可盛装A和D的最高价含氧酸的浓溶液
B. AE3、D2E2分子中所有原子最外层均达到8电子结构
C. B、D、E的单质或者化合物中都可能有能作漂白剂的物质
D. 工业上分别电解熔融的B与E、C与E形成的化合物制备B、C单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶上的标签,

试根据有关数据回答下列问题:
(1)该浓盐酸的物质的量浓度为___________mol/L。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是__________。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某实验需要480 mL物质的量浓度为0.3 mol/L稀盐酸。某学生用上述浓盐酸和蒸馏水进行配制。
①该学生需要用量筒量取___________ mL上述浓盐酸进行配制。该实验中玻璃棒的作用有_________________________________。
②配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)_________________。
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量水(约30mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1—2cm处
③在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(填 “偏高”或“偏低”或“无影响”)。
用量筒量取浓盐酸时俯视观察凹液面_________________。
溶液注入容量瓶前没有恢复到室温就进行定容_________________。
容量瓶用水洗完后,用稀盐酸润洗,且没有干燥就直接使用_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用2个Cl取代甲醛分子中的H可得到碳酰氯,下列描述正确的是
A. 碳酰氯分子为平面三角形,分子中存在一个π键
B. 碳酰氯分子中的C原子为sp3杂化
C. 甲醛分子中的H-C-H键角与碳酰氯分子中的Cl-C-Cl相等
D. 甲醛分子中有4个σ键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一般较强酸可制取较弱酸,这是复分解反应的规律之一。已知在常温下测得浓度均为0.1mol/L的下列 3 种溶液的 pH:
溶质 | NaHCO3 | Na2CO3 | NaClO |
pH | 8.34 | 11.6 | 10.3 |
下列有关说法正确的是( )
A. 以上溶液的 pH 是用广泛 pH 试纸测定的
B. 反应CO2+H2O+2NaClO=Na2CO3+2HClO可以发生
C. 室温下,电离常数: K2( H2CO3)>K( HClO)
D. 在新制氯水中加入少量 NaHCO3固体可以提高溶液中 HClO 的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述正确的是( )
A. ClO3-的空间构型为平面三角形
B. SiF4和SO32-的中心原子均为sp2杂化
C. C2H2分子中σ键与π键的数目比为1︰1
D. SF6中有6对相同的成键电子对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国《Scinece》杂志曾报道科学家合成和分离出含高能正离子![]() 的化合物N5AsF6,有研究者预想合成一个纯粹由氮组成的新物种
的化合物N5AsF6,有研究者预想合成一个纯粹由氮组成的新物种 ![]() ,若
,若![]() 离子中每个氮原子均满足8电子结构,下列关于含氮微粒的表述正确的是
离子中每个氮原子均满足8电子结构,下列关于含氮微粒的表述正确的是
A. ![]() 中N原子间形成离子键B. N5AsF6中As的化合价为+1
中N原子间形成离子键B. N5AsF6中As的化合价为+1
C. ![]() 的摩尔质量为112D.
的摩尔质量为112D. ![]() 所含质子数为21
所含质子数为21
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F六种物质,它们的相互转化关系如下图(反应条件略,有些反应的产物和反应的条件没有全部标出)。已知A、B、E是单质,其中A着火只能用干燥的沙土灭火,B在常温下为气体,C俗名称为烧碱,D为无色无味液体。

(1)写出A、B、F的化学式 A______ B ______ F ______。
(2)写出A和D反应生成B和C的化学方程式_____________。若生成3mol的B,则转移的电子数目为_______________ 。
(3)写出E与C、D反应生成的B和F离子方程式____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将质量比为4:5的SO2和SO3混合,则混合气体中SO2和SO3的物质的量之比为__,硫原子和氧原子个数之比为___。
(2)将5mol/L盐酸10mL稀释到200mL,稀释后溶液的物质的量浓度是__。
(3)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为__。
(4)已知15.6gNa2X固体中含有0.4molNa+。请计算:
a.X的相对原子质量为__。
b.将39gNa2X固体溶解到水中,并加水稀释至2L,则所得溶液中Na+的物质的量浓度为___mol/L。
(5)质量都是10g的HCl、NH3、CO2、H2四种气体在标准状况下,体积最小的是__;密度最小的是__。(填化学式)
(6)漂白粉是用Cl2与___(填化学式)反应来制取的,漂白粉是___(填“混合物”或“纯净物”),其有效成分为__(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com