
【题目】[化学——有机化学基础]
某吸水材料与聚酯纤维都是重要化工原料,它们的合成路线如下:
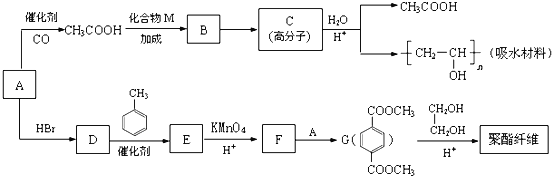
已知:①有机物A能与Na反应,相对分子质量为32。
②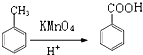
③RCOOR′+R″OH![]() RCOOR″+R′OH(R、R、R,代表烃基)
RCOOR″+R′OH(R、R、R,代表烃基)
(1)A的结构简式是____________,B中含氧官能团的名称是_____________。
(2)C的结构式是_______________,D→E的反应类型是_________________。
(3)F+A→G的化学方程式是_________________________。
(4)CH3COOH+CH≡CH→B的化学方程式是______________。
(5)G的同分异构体有多种,满足下列条件的共有___________种。
①苯环上只有两个取代基
②1mol与足量的NaHCO3溶液反应生成2mol CO2气体
(6)G→聚酯纤维的化学方程式是_______________________________。
【答案】CH3OH 酯基 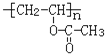 取代反应
取代反应 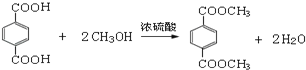 CH3COOH+CH≡CH→
CH3COOH+CH≡CH→![]() 12
12 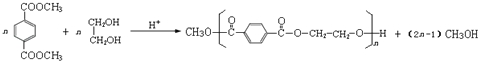
【解析】
(1)已知有机物A能与Na发应,相对分子质量为32,可得A为甲醇,结构简式是CH3OH。逆推可知,将CH3COOH和吸水材料酯化即C,其结构简式为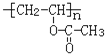 ,而B为C的单体,所以B的结构简式为CH3COOCH=CH2, 则B中含氧官能团是酯基。
,而B为C的单体,所以B的结构简式为CH3COOCH=CH2, 则B中含氧官能团是酯基。
(2)由(1)可知C的结构简式是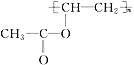 ,A为CH3OH与HBr发生取代发应生成D(CH3Br),根据G的结构逆推可知F为
,A为CH3OH与HBr发生取代发应生成D(CH3Br),根据G的结构逆推可知F为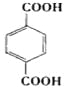 ,则E为D(CH3Br)与甲苯发生对位上取代反应的产物,即对二甲苯。
,则E为D(CH3Br)与甲苯发生对位上取代反应的产物,即对二甲苯。
(3)根据(2)的分析,F + A → G的化学方程式为
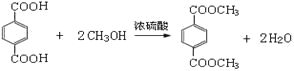 。
。
(4)根据B的结构简式可知该反应为加成反应,化学方程式为:
CH3COOH+CH≡CH→![]() 。
。
(5)满足条件的G的同分异构体共有12种,为![]() (邻、间、对3种)、
(邻、间、对3种)、![]() (邻、间、对3种)、
(邻、间、对3种)、![]() (邻、间、对3种)、
(邻、间、对3种)、![]() (邻、间、对3种)。
(邻、间、对3种)。
(6)G→聚酯纤维的反应是缩聚反应,反应化学方程式为:
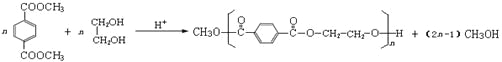 。
。


科目:高中化学 来源: 题型:
【题目】汽车内燃机燃烧时,在高温引发氮气和氧气反应会产生 NOx 气体,NOx 的消除是科研人员研究的重要课题。
(1)通过资料查得 N2(g)+O2(g)2NO(g)△H反应温度不平衡常数的关系如下表:
反应温度/℃ | 1538 | 2404 |
平衡常数 |
|
|
则△H___________________0(填“<”“>”戒“=”)
(2)在 800℃时,测得 2NO(g)+O2(g) 2NO2(g)的反应速率不反应物浓度的关系如下表所示
初始浓度/ | 初始速率/ | |
C0(NO) | C0(O2) | |
0.01 | 0.01 |
|
0.01 | 0.02 |
|
0.03 | 0.02 |
|
已知反应速率公式为 V 正=K 正×c m(NO)cn(O2),则 m=___________________, K 正=___________________L2mol-2s-1
(3)在某温度下(恒温),向体积可变的容器中充人 NO2 气体,发生反应 2NO2(g) N2O4(g),气体分压随时间的变化关系如图
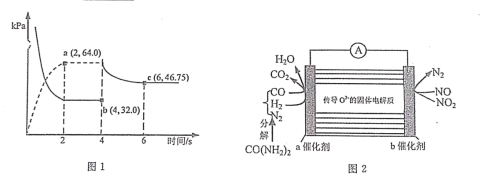
①该反应的压力平衡常数 KP=___________________。
②4s 时压缩活塞(活塞质量忽略不计)使容器体积变为原体积的 1/2,6s 时重新达到平衡,则P(N2O4)=___________________kPa。
(4)某学习小组利用图 2 装置探究向汽车尾气中喷入尿素溶液处理氮的氧化物。则该装置工作时,NO2 在 b 电极上的电极反应式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝、铁、硅的单质及化合物在工业生产中具有广泛应用,工业上常用某矿石(主要成分有Al2O3、Fe2O3、FeO、SiO2等)来制备绿矾(FeSO4·7H2O)和氧化铝,其工艺流程如图:
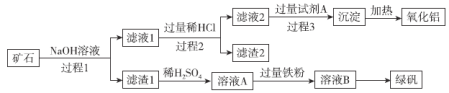
回答下列问题:
(1)滤渣1的成分是___,举例说明滤渣2的用途___。
(2)用离子方程式表示溶液A加入过量铁粉的目的是___。
(3)写出由滤液1生成滤液2的离子方程式___。
(4)过程1、2、3均涉及分离操作,所需玻璃仪器有___。
(5)由溶液B得到绿矾的具体操作为___、过滤、洗涤和干燥。
(6)过程3需要加入的试剂A是___,写出此过程的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向质量为6.5g的Al和Fe的混合物中加入一定量稀HNO3恰使混合物完全溶解,放出NO(标准状况)2.24L,所得溶液中再滴加KSCN溶液,无红色出现。若用相同质量的上述混合物与足量的稀硫酸充分反应,所得到的气体在标准状况下的体积为( )
A.15.12LB.10.08LC.2.24LD.3.36L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等。可由电镀废渣(除含镍外,还含有Cu、Zn、Fe、Cr等杂质)为原料获得。工艺流程如下图:
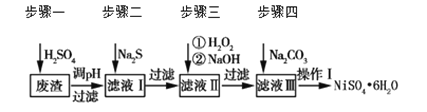
请回答下列问题:
(1)用稀硫酸溶解废渣时,为了提高浸取率可采取的措施有_______(任写一点)。
(2)向滤液中滴入适量的Na2S溶液,目的是除去Cu2+、Zn2+,写出除去Cu2+的离子方程式________。
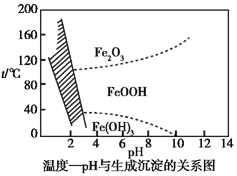
(3)在40 ℃左右,用6%的H2O2氧化Fe2+,再在95 ℃时加入NaOH调节pH,除去铁和铬。此外,还常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠![]() (OH)12]沉淀除去。如图是温度—pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域[已知25 ℃时,Fe(OH)3的Ksp=2.64×10-39]。下列说法正确的是_______(选填序号)。
(OH)12]沉淀除去。如图是温度—pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域[已知25 ℃时,Fe(OH)3的Ksp=2.64×10-39]。下列说法正确的是_______(选填序号)。
a.FeOOH中铁为+2价
b.若在25 ℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10-29
c.用氯酸钠在酸性条件下氧化Fe2+的离子方程式为:6Fe2++Cl![]() +6H+
+6H+![]() 6Fe3++Cl-+3H2O
6Fe3++Cl-+3H2O
d.工业生产中常保持在85~95 ℃生成黄铁矾钠,此时水体的pH为1.2~1.8
(4)上述流程中滤液Ⅲ的主要成分是_______。
(5)确定步骤四中Na2CO3溶液足量,碳酸镍已完全沉淀的简单实验方法是_______。
(6)操作Ⅰ的实验步骤依次为(实验中可选用的试剂:6 mol·L-1的H2SO4溶液、蒸馏水、pH试纸):
①___________;
②___________;
③蒸发浓缩、冷却结晶,过滤得NiSO4·6H2O晶体;
④用少量乙醇洗涤NiSO4·6H2O晶体并晾干。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡酸钠用于制造陶瓷电容器的基体、颜料和催化剂。工业上以锡碲渣(主要含Na2SnO3和Na2TeO3)为原料,制备锡酸钠的工艺流程图如下,请回答下列问题:
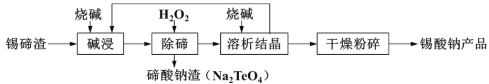
已知:锡酸钠(Na2SnO3)和亚碲酸钠(Na2TeO3)均易溶于碱。
(1)“碱浸”过程中,锡碲浸出率与溶液中游离碱质量浓度关系如图所示,则最理想的质量浓度为__________,理由是______________。
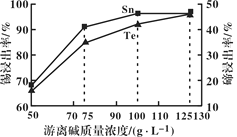
(2)如图反映的是“除碲”过程中反应温度对碲脱除率的影响关系,70℃后随温度升高碲脱除率下降的原因可能是______________。
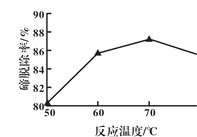
(3)“除碲”反应的离子方程式为_________________。
(4)从“溶析结晶”回到“碱浸”的物质除烧碱外,主要还有_____________(写化学式)。
(5)“溶析结晶”母液中还含有少量SbO43-,可用锡片将Sb置换出来,锡转化成最高价含氧酸盐,写出反应的离子方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表、元素周期律及其相关应用叙述正确的是( )
A.原子的种类和元素的种类一样多
B.在现行元素周期表中,所含元素种数最多的是ⅢB族
C.可以在元素周期表金属与非金属分界处寻找催化剂
D.IA族的元素全部是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以水为溶剂进行中和滴定的原理是:H3O++OH-=2H2O.已知液态SO2和纯水的导电性相近,因为液态SO2也会发生自离解:SO2(l)+SO2(l)![]() SO32-+SO2+.若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是 ( )
SO32-+SO2+.若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是 ( )
A. 该滴定反应可以表示为:SO32-+ SO2+=2SO2
B. 在一定温度下,液态SO2中c(SO32-)与c(SO2+)的乘积是一个常数
C. 自离解的存在,说明SO2是离子化合物
D. 可通过导电能力变化来判断是否到达滴定终点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁是目前应用最广泛的金属材料,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命。
(1)抗腐蚀处理前,生产中常用盐酸来除铁锈。现将一表面生锈的铁件放入盐酸中,当铁锈除尽后,溶液中发生的化合反应的化学方程式为__________________。
(2)利用如图装置,可以模拟铁的电化学防护。
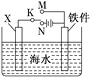
①若X为碳棒,为减缓铁件的腐蚀,开关K应置于________________处。
②若X为锌,开关K置于M处,该电化学防护法称为__________。
(3)图中若X为粗铜,容器中海水替换为硫酸铜溶液,开关K置于N处,一段时间后,当铁件质量增加3.2 g时,X电极溶解的铜的质量____3.2 g(填“<”“>”或“=”)。
(4)图中若X为铜,容器中海水替换为FeCl3溶液,开关K置于M处,铜电极发生的反应是______________________,若将开关K置于N处,发生的总反应是_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com