
【题目】已知A是一种常见金属,F 是一种红褐色沉淀,试根据图中转化关系,回答下列问题。
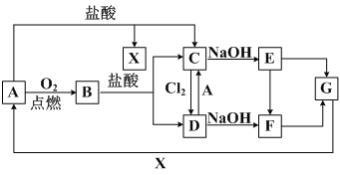
(1)写出A、C、F、G的化学式:A_________,C________,F________,G_________。
(2) 检验D中阳离子的方法为________________________
(3) 保存C溶液时要加固体A的原因__________________
(4) 写出下列转化的离子方程式或化学方程式。
①E→F 的化学反应方程式:_________________________
②C→D的离子反应方程式:_________________________
【答案】Fe FeCl2 Fe(OH)3 Fe2O3 取D溶液少许于试管中,加入几滴KSCN溶液,溶液变红色,证明含Fe3+(答案合理即可) 防止Fe2+被O2氧化变质 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Fe2++Cl2=2Fe3++2Cl-
【解析】
A是一种常见金属,F是一种红褐色沉淀,由转化关系可知F为Fe(OH)3,A为Fe,Fe与氧气反应生成B为Fe3O4,四氧化三铁与盐酸反应得到氯化亚铁与氯化铁,故Fe与盐酸反应得到X为氢气、C为FeCl2,可推知E为Fe(OH)2、D为FeCl3,G为Fe2O3。
(1)根据分析可知A为Fe,C为FeCl2,F为Fe(OH)3,G为Fe2O3,故答案为:Fe;FeCl2;Fe(OH)3;Fe2O3;
(2)D为FeCl3,含有阳离子为Fe3+,检验Fe3+离子的方法为:取少量D溶液于试管中,滴加几滴KSCN溶液,若溶液变红色,证明有Fe3+,故答案为:取D溶液少许于试管中,加入几滴KSCN溶液,溶液变红色,证明含Fe3+(答案合理即可);
(3)FeCl2易被空气中氧气氧化,保存FeCl2溶液时加固体Fe,防止Fe2+被氧气氧化,故答案为:防止Fe2+被氧气氧化;
(4)E转化为F是氢氧化亚铁被氧气氧化生成氢氧化铁,现象是:白色沉淀迅速变成灰绿色,最后变成红褐色;反应化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,C→D反应离子方程式为:2Fe2++Cl2═2Fe3++2Cl-;故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3 ;2Fe2++Cl2=2Fe3++2Cl-。


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案科目:高中化学 来源: 题型:
【题目】查阅资料:元素铬(Cr)在溶液中主要以Cr3+(蓝紫色) 、Cr(OH)4-(绿色) 、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
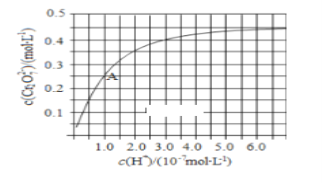
(1)CrO42和Cr2O72在溶液中可相互转化。室温下,初始浓度为1.0 mol·L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如右图所示。
①用离子方程式表示Na2CrO4溶液中的转化反应____________。
②由图可知,溶液酸性增大,CrO42的平衡转化率________(填“增大“减小”或“不变”)。
③升高温度,溶液中CrO42的平衡转化率减小,则该反应的ΔH____0(填“>”“<”或“=”)。
(2)欲降低废水中重金属元素铬的毒性,可将Cr2O72-转化为Cr(OH)3沉淀除去.已知:某含铬废水处理的主要流程如图所示:
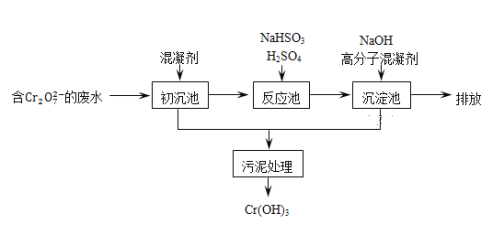
①初沉池中加入的混凝剂是K2SO4·Al2(SO4)3·24H2O,其作用为__________(用离子方程式表示).
②反应池中用NaHSO3将酸性废液中的Cr2O72-还原成Cr3+,该反应的离子方程式为________.根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子的先后顺序是____________。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Fe2+ | 7.0 | 9.0 |
Fe3+ | 1.9 | 3.2 |
Cr3+ | 6.0 | 8.0 |
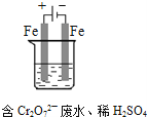
(3)工业可用电解法来处理含 Cr2O72-废水。实验室利用如图模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-═Fe2+,阴极反应式是2H++2e-═H2↑,Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是__________,得到的金属阳离子在阴极区可沉淀完全,用电解法处理该溶液中0.01mol Cr2O72-时,至少得到沉淀的质量是__________ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究乙烯与溴的加成反应,甲同学设计并进行了如下实验:先取一定量的工业用乙烯气体(在储气瓶中),使气体通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应。
乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊物质,推测在工业上制得的乙烯中还可能含有少量还原性的气体杂质,由此他提出必须先除去杂质,然后再使乙烯与溴水反应。
请你回答下列问题:
(1)甲同学的实验中有关的化学方程式为___________。
(2)甲同学设计的实验____(填“能”或“不能”)验证乙烯与溴发生加成反应,其理由是____。
①使溴水褪色的反应,未必是加成反应
②使溴水褪色的反应,就是加成反应
③使溴水褪色的物质,未必是乙烯
④使溴水褪色的物质,就是乙烯
(3)乙同学推测此乙烯中必定含有的一种杂质气体是____,它与溴水反应的化学方程式是___________。在验证过程中必须全部除去杂质气体,除去该杂质的试剂可选用_______。
(4)为了验证乙烯与溴水的反应是加成反应而不是取代反应,可采取的方法有___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“套管实验”是将一个较小的玻璃仪器装入另外一个玻璃仪器中,经组装来完成原来需要两只或更多普通玻璃仪器进行的实验。因其具有许多优点,近年被广泛开发并应用于化学实验中。下述实验为“套管实验”,请观察如图所示实验装置,分析实验原理,回答下列问题:
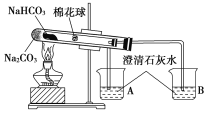
(小试管内塞有沾有无水硫酸铜粉末的棉花球)
(1)从点燃酒精灯开始,试管及烧杯B中能观察到的现象有____________________。
(2)通过该实验可得出的结论是_________________________________。
(3)本装置的优点是_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硝酸中的一步重要反应是NH3在加热条件下催化氧化:4NH3+5O2![]() 4NO+6H2O这是一个正反应放热的可逆反应,如果反应在密闭容器中进行,下列说法中错误的是
4NO+6H2O这是一个正反应放热的可逆反应,如果反应在密闭容器中进行,下列说法中错误的是
A.使用催化剂可以加快反应速率,提高生产效率
B.适当提高O2的浓度可以提高NH3的转化率
C.升高温度,正反应速率增大、逆反应速率减小
D.NH3的转化率为最大值时,该反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实或实验现象的化学用语正确的是
A. 硫酸酸化的KI淀粉溶液久置后变蓝:4I-+O2 + 4H+ ![]() 2I2+2H2O
2I2+2H2O
B. 铁和稀硝酸反应制得浅绿色溶液:Fe + 4H+ + NO3-![]() Fe3+ + NO↑+ 2H2O
Fe3+ + NO↑+ 2H2O
C. 水垢上滴入CH3COOH溶液有气泡产生:CaCO3+2H+ ![]() Ca2++CO2↑+ H2O
Ca2++CO2↑+ H2O
D. SO2通入漂白粉溶液中产生白色浑浊:SO2+Ca2++2ClO-+H2O ![]() CaSO3↓+2HClO
CaSO3↓+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向盛有25mLpH=12的一元碱MOH溶液的绝热容器中滴加0.05mol·L-1H2SO4溶液,加入H2SO4溶液的体积(V)与所得混合溶液温度(T)的关系如图所示。下列说法正确的是( )
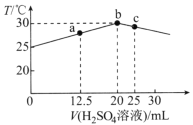
A.应选用酚酞作指示剂
B.a点溶液中存在:c(MOH)+c(M+)<4c(SO![]() )
)
C.水的电离程度:a<b<c
D.b→c的过程中,温度降低的主要原因是溶液中发生了吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】囧烷(G)是一种重要的烃,一种合成囧烷的路线如图所示:
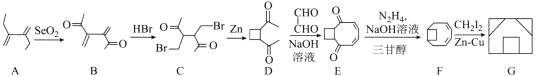
已知: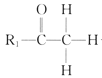 +R2—CHO
+R2—CHO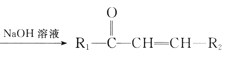 +H2O。
+H2O。
请回答下列问题:
(1)A的化学名称为___;G的分子式为__。
(2)B→C的反应类型为___;C中所含官能团的名称为__。
(3)D→E的化学方程式为___。
(4)同时满足下列条件的B的同分异构体有__种(不考虑立体异构);其中核磁共振氢谱有5组峰的结构简式为___。
①属于芳香族化合物且苯环上连有3个取代基。
②与FeC13溶液发生显色反应。
(5)参照上述合成路线和信息,以![]() 为原料(其他试剂任选),设计制备
为原料(其他试剂任选),设计制备![]() 的合成路线:___。
的合成路线:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的资源化利用能有效减少CO2排放,充分利用碳资源。
(1)CaO可在较高温度下捕集CO2,在更高温度下将捕集的CO2释放利用。CaC2O4·H2O热分解可制备CaO,CaC2O4·H2O加热升温过程中固体的质量变化见下图。

①写出400~600 ℃范围内分解反应的化学方程式:________。
②与CaCO3热分解制备的CaO相比,CaC2O4·H2O热分解制备的CaO具有更好的CO2捕集性能,其原因是________。
(2)电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理示意图如下。

①写出阴极CO2还原为HCOO的电极反应式:________。
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是________。
(3)CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应Ⅰ:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH =41.2 kJ·mol1
CO(g)+H2O(g) ΔH =41.2 kJ·mol1
反应Ⅱ:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol1
CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol1
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:

CH3OCH3的选择性=![]() ×100%
×100%
①温度高于300 ℃,CO2平衡转化率随温度升高而上升的原因是________。
②220 ℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施有________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com