
【题目】在2L密闭容器内,t℃时发生反应:N2(g)+3H2(g)![]() 2NH3(g),在体系中,n(N2)随时间的变化如下表:
2NH3(g),在体系中,n(N2)随时间的变化如下表:
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
N2的物质的量(mol) | 0.20 | 0.10 | 0.08 | 0.06 | 0.06 | 0.06 |
(1)上述反应在第5min时,N2的转化率为___;
(2)用H2表示从0~2min内该反应的平均速率v(H2)=___;
(3)t℃时,在4个均为2L密闭容器中不同投料下进行合成氨反应。根据在相同时间内测定的结果,判断该反应进行快慢的顺序为___。(用字母填空,下同);
a.v(NH3)=0.05mol·L-1·min-1
b.v(H2)=0.03mol·L-1·min-1
c.v(N2)=0.02mol·L-1·min-1
d.v(H2)=0.00lmol·L-1·s-1
(4)下列表述能作为反应达到化学平衡状态的标志是___。
a.反应速率v(N2)∶v(H2) ∶v(NH3)=1∶3∶2
b.各组分的物质的量浓度不再改变
c.混合气体的平均相对分子质量不再改变
d.混合气体的密度不变
【答案】70% 0.09mol/(Lmin) a>c=d>b bc
【解析】
(1)N2的初始物质的量0.20mol,第5min时,N2的物质的量为0.06mol,根据转化率的计算公式计算;
(2)根据v=![]() ,结合v(H2)=3v(N2)计算;
,结合v(H2)=3v(N2)计算;
(3)同一化学反应中,同一时间段内,各物质的反应速率之比等于其计量数之比分析判断;
(4)根据化学平衡状态的特征分析判断。
(1)N2的初始物质的量0.20mol,第5min时,N2的物质的量为0.06mol,已经转化的氮气的物质的量为0.20mol-0.06mol=0.14mol,反应在第5min时,N2的转化率=![]() ×100%=70%,故答案为:70%;
×100%=70%,故答案为:70%;
(2)N2的初始物质的量0.20mol,第2min时,N2的物质的量为0.08mol,从0~2min内已经转化的氮气的物质的量为0.20mol-0.08mol=0.12mol,则v(N2)=![]() =
=![]() =
= =0.03mol/(Lmin),v(H2)=3v(N2)=0.09mol/(Lmin),故答案为:0.09mol/(Lmin);
=0.03mol/(Lmin),v(H2)=3v(N2)=0.09mol/(Lmin),故答案为:0.09mol/(Lmin);
(3)反应为N2(g)+3H2(g)2NH3(g),以氢气的反应速率为标准进行判断;
a.v(NH3)=0.05mol/(Lmin),反应速率之比等于其计量数之比,所以ν(H2)=0.075mol/(Lmin);
b.ν(H2)=0.03mol/(Lmin);
c.ν(N2)=0.02mol/(Lmin),反应速率之比等于其计量数之比,所以ν(H2)=0.06mol/(Lmin);
d.v(H2)=0.00l mol/(Ls) =0.06mol/(Lmin);
所以该反应进行快慢的顺序为a>c=d>b,故答案为:a>c=d>b;
(4)a.反应速率之比等于化学计量数之比,无论是否达到平衡状态,都存在反应速率v(N2)∶v(H2)∶v(NH3)=1∶3∶2,不能用于判断是否是平衡状态,故a错误;
b.各组分的物质的量浓度不再改变,可说明正、逆反应速率相等,达到平衡状态,故b正确;
c.该反应为气体的物质的量减小的反应,混合气体的平均相对分子质量不再改变,说明气体的总物质的量不变,可说明达到平衡状态,故c正确;
d.混合气体的总质量不变,容器的体积不变,则无论是否达到平衡,混合气体的密度都不变,因此混合气体的密度不变,不能用于判断是否是平衡状态,故d错误;
故答案为:bc。


科目:高中化学 来源: 题型:
【题目】碱式氯化铜为绿色或墨绿色结晶性粉末,难溶于水,溶于稀酸和氨水,在空气中十分稳定。
Ⅰ.模拟制备碱式氯化铜。向![]() 溶液中通入
溶液中通入![]() 和
和![]() ,调节pH至5.0~5.5,控制反应温度于70~80℃,实验装置如图所示(部分夹持装置已省略)。
,调节pH至5.0~5.5,控制反应温度于70~80℃,实验装置如图所示(部分夹持装置已省略)。
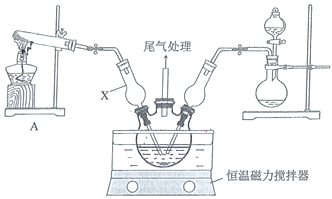
(1)仪器X的名称是________,其主要作用有导气、________。
(2)实验室利用装置A制![]() ,发生反应的化学方程式为________。
,发生反应的化学方程式为________。
(3)反应过程中,在三颈烧瓶内除观察到溶液蓝绿色褪去,还可能观察到的现象是________、________、________。
(4)若体系![]() 过高会导致碱式氯化铜的产量_______(填“偏高”、“偏低”或“无影响”)。
过高会导致碱式氯化铜的产量_______(填“偏高”、“偏低”或“无影响”)。
(5)反应结束后,将三颈瓶中的混合物过滤,从滤液中还可以获得的副产品是________(填化学式),经提纯得产品无水碱式氯化铜。
Ⅱ.无水碱式氯化铜组成的测定。称取产品![]() ,加硝酸溶解,并加水定容至200mL,得到待测液。
,加硝酸溶解,并加水定容至200mL,得到待测液。
(6)铜的测定:取20.00mL测液,经测定,![]() 浓为
浓为![]() 。则称取的样品中
。则称取的样品中![]() ________mol。
________mol。
(7)采用沉淀滴定法测定氯:用![]() 标准溶液滴定过量的
标准溶液滴定过量的![]() ,实验如图:
,实验如图:

①滴定时,应选用下列哪种物质作为指示剂________(填标号)。
A.![]() B.
B.![]() C.
C.![]()
②重复实验操作三次,消耗![]() 溶液的体积平均为10.00mL。则称取的样品中
溶液的体积平均为10.00mL。则称取的样品中![]() ______mol。
______mol。
(8)根据上述实验结果可推知无水碱式氯化铜的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOC1)是一种黄色气体,沸点为-5.5℃。其液体呈红褐色。遇水发生反应:2NOC1+H2O=2HC1+NO↑+NO2↑。某化学兴趣小组设计如图装置用C12和NO制备NOC1。回答下列相关问题:
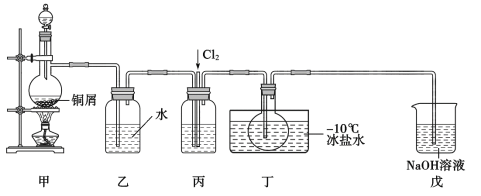
(1)甲装置发生的离子反应方程式为__,装置丙中的液体为__。
(2)实验时,先通入Cl2,待丁中烧瓶内充满黄绿色气体时,再通入NO,这样做的目的是__。
(3)装置丁中冰盐水的作用是__。
(4)经分析该套装置设计上有一处明显缺陷,改进方法是__(用文字描述)。
(5)吸收尾气时,NOCl发生反应的化学方程式为__。
(已知:NO+NO2+2NaOH=2NaNO2+H2O)
(6)反应完成后,取烧瓶中所得产物mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为VmL。则产物中NOCl纯度的计算式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年国际计量大会将“摩尔”的定义修改为:1摩尔包含6.02214076×1023个基本单元,这一常数被称为阿伏加德罗常数(NA),通常用6.02×1023 mol-1表示,新定义于2019年5月20日正式生效。下列说法不正确的是
A.标准状况下,22.4L的NH3约含有10×6.02×1023个质子
B.由新定义可知,阿伏加德罗常数表达为NA=6.02214076×1023 mol-1
C.标准状况下,18gH2O中约含有1×6.02×1023个氧原子
D.白磷分子(P4)呈正四面体结构,62g白磷中约含有12×6.02×1023个P-P键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类应用较早,当前应用量最大的金属元素。下列有关说法中正确的是( )
A.人类使用铁制品在铝之后
B.常温下,铁不能与浓硝酸反应
C.铁与水蒸气在高温下的反应产物为Fe2O3和H2
D.除去FeCl3溶液中的FeCl2杂质可以向溶液中加入适量氯水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠及其重要化合物之间的转化关系如图所示:
![]()
回答下列问题;
(1)钠元素在周期表中的位置___,少量的钠应保存在___。
(2)Na2O2的颜色为___,其用途为___。
(3)反应①中的氧化剂是___。
(4)反应①中4.6g的金属钠与足量的水反应生成标况下___L氢气,转移的电子的物质的量为___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.1.2g金刚石中含有的共价键数为0.4NA
B.标准状况下,2.24 L CCl4含有个0.1 NA个CCl4分子
C.常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.4NA
D.1 mol固体NaHSO4中含有阳离子的数目是2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用甲苯合成苯甲醛:
 ,
,
下列说法正确的是
A. 甲苯分子中所有原子都在同一平面内 B. 反应①②③的反应类型相同
C. 一氯甲苯的同分异构体有3种 D. 苯甲醇可与金属钠反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图所示的有机物X可生产S—诱抗素Y。下列说法正确的是( )

A.X和Y都可以与FeCl3溶液发生显色反应
B.1 mol Y最多能加成3 mol H2
C.l mol X与足量NaOH溶液反应,最多消耗6 mol NaOH
D.X到Y的反应是水解反应或取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com