A��B��C��X��Ϊ��ѧ�����Ĵ��������֮��������ת����ϵ������������ȥ�����Իش�

��1����A���Ҵ�����C�Ľṹ��ʽ��
CH3COOH
CH3COOH
����Ӧ�ٵĻ�ѧ����ʽ
��2001��5�£��й��������ƹ㡰�����Ҵ����͡�����ν�Ҵ����;�������Ǧ��������������Ҵ���϶��ɵ�һ��ȼ�ϣ�����������һ���������
A
A
��
A���Ҵ�������һ�����͵Ļ�����
B������ʹ���Ҵ������ܼ����к�������ŷ�
C����ҵ�����ѻ��ķ���������͵IJ���
D�������ס��������Ϳ����Ƶ��Ҵ�
��2����A��һ�ֹ�ҵ������ĺ�����Ԫ�ؿ�������Ҫ�ɷ֣���A�Ļ�ѧʽΪ
FeS2
FeS2
����Ӧ�ڵĻ�ѧ����ʽ
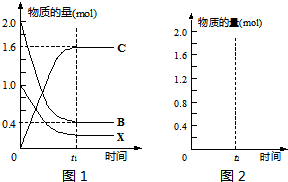
��ij�¶�Tʱ����һ��������2L�ܱ������У���Ӧ�ڴ���ʼ��ƽ���Ĺ�ϵ��ͼ1��ʾ�����ͼ�ش��������⣺
������B��ת����
80%
80%
��
������¶��·�Ӧ�ڵ�ƽ�ⳣ��
160
160
��
����������ͬ�����£�����ͬ��������Ͷ��2mol C��t
2ʱ�̴ﵽƽ�⣮����ͼ2�л����ӷ�Ӧ��ʼ��ƽ�����������ʵ�����ʱ��Ĺ�ϵͼ
��








 ѧ���쳵�����ּ��������ҵ�½����������ϵ�д�
ѧ���쳵�����ּ��������ҵ�½����������ϵ�д� �����ѧСѧ�꼶�νӵ������㽭��ѧ������ϵ�д�
�����ѧСѧ�꼶�νӵ������㽭��ѧ������ϵ�д� Сѧ�����ҵ���ϴ�ѧ������ϵ�д�
Сѧ�����ҵ���ϴ�ѧ������ϵ�д� ���Ž�����ٰθ��νӹ㶫���������ϵ�д�
���Ž�����ٰθ��νӹ㶫���������ϵ�д� �����������ҵ�������������ϵ�д�
�����������ҵ�������������ϵ�д�




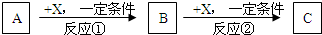

 ����3�ֻ�����A��B��C����������Ԫ��R����ת����ϵ��ͼ��ʾ��
����3�ֻ�����A��B��C����������Ԫ��R����ת����ϵ��ͼ��ʾ��
