

| ||
| ||
| 10-2×x×V1×10-3 |
| 0.25 |
| 5cV2 |
| V1 |
| 5cV2 |
| V1 |
| 337.5CV2 |
| V1 |
| 337.5CV2 |
| V1 |


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
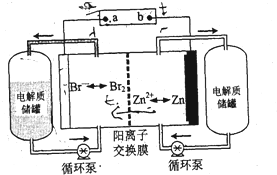 锌溴液流电池是一种新型电化学储能装置(如图所示)电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环,下列说法正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示)电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环,下列说法正确的是( )| A、充电时电极b连接电源的正极 |
| B、放电时正极的电极反应式为Zn-2e-=Zn2+ |
| C、阳离子交换膜可阻止Br2与Zn直接发生反应 |
| D、充电时左侧电解质储罐中的离子总浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 检验试剂 | 预期现象与结论 |
| 装置III的试管中加入 | 产生白色沉淀,证明气体产物中含有SO3. |
| 装置IV的试管中加入 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.2mol?L-1 |
| B、0.1mol?L-1 |
| C、2.0mol?L-1 |
| D、1.0mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com