
【题目】下列有关叙述正确的是( )
A. 只含有离子键的化合物才是离子化合物
B. 硫酸铵晶体是含有离子键、极性键和配位键的分子晶体
C. 由于I-I键的键能比F-F、Cl-Cl、Br-Br键的键能都小,所以在卤素单质中碘的熔点最低
D. 在分子晶体中一定不存在离子键,而在离子晶体中可能存在共价键
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】某课外小组分别用如图所示装置对原电池和电解原理进行实验探究.请回答:

Ⅰ.用图 1 所示装置进行第一组实验.
(1)在保证电极反应不变的情况下,不能替代 Cu 作电极的是________(填字母序号).
A.石墨 B.铝 C.铂 D.银
(2)N 极发生反应的电极反应式为__________________________________.
Ⅱ.用图 2 所示装置进行第二组实验.实验过程中,观察到与第一组实验不同的现象:两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清. 查阅资料得知,高铁酸根离子(FeO42﹣)在溶液中呈紫红色.
(3)电解过程中,X 极区溶液的 pH________(填“增大”“减小”或“不变”).
(4)电解过程中,Y 极发生的电极反应之一为 Fe﹣6e﹣+8OH﹣═FeO42﹣+4H2O 若在 X 极收集到672mL 气体,在 Y 极收集到 168mL 气体(均已折算为标准状况时气体体积),则 Y 电极(铁 电极)质量减少________g.
(5)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2.该电池负极发生的反应的电极反应式为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】查阅医学资料,得知扁桃酸衍生物是重要的医药中间体,工业合成扁桃酸衍生物D路线如下:
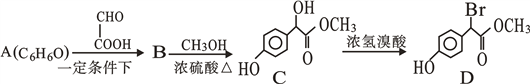
(1)A的结构式:_____。
(2)B含的官能团名称:_________ 。
(3) 写B生成C的化学方程式____________________________。
(4) C→D的反应类型是__________,1 mol D在一定条件下与足量NaOH溶液反应,最多消耗NaOH的物质的量为_________mol。
(5)写出乙醛与A在一定条件下发生缩聚反应的化学方程式______________________(不要求指明反应条件)。
(6)同时符合下列条件的D的所有同分异构体(不考虑立体异构)有____种;
①能与NaHCO3溶液反应产生气体;
②苯环上只有2个取代基;
③遇氯化铁溶液发生显色反应。其中核磁共振氢谱显示为5组峰,且峰面积比为3:1:2:2:1的同分异构体是__________________(写结构简式)。
(7)已知: ,请设计合成路线以A和C2H2为原料合成
,请设计合成路线以A和C2H2为原料合成![]() (无机试剂任选):________________________。
(无机试剂任选):________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙醇、石墨和氢气的燃烧热分别为a、b、c(均为正值,单位均为kJ·mol-1)。则反应2C(s,石墨)+2H2(g)+H2O(l)==C2H5OH(l)的焓变为( )
A. (2b+2c-a) kJ·mol-1 B. (b+c-a) kJ·mol-1
C. (a-2b-2c) kJ·mol-1 D. (a-2b-c) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色溶液中,下列离子能大量共存的是
A.Na+、NH4+ 、NO3-、MnO4-B.K +、SO42-、OH-、AlO2-
C.K +、Fe3+ 、Cl-、Br-D.Ba2+ 、Na+ 、OH-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下(T2> Tl),在3个体积均为2.0 L的恒容密闭容器中反应 2NO(g)+ Cl2(g) = 2ClNO(g)(正反应放热)达到平衡,下列说法正确的是

A. 达到平衡时,容器I与容器II中的总压强之比为1:2
B. 达到平衡时,容器III中ClNO的转化率小于80%
C. 达到平衡时,容器II中c(ClNO(/ c(NO)比容器I中的大
D. 若温度为Tl,起始时向同体积恒容密闭容器中充入0.20 mol NO(g)、0.2 mol Cl2(g)和0.20 mol ClNO(g),则该反应向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列现象或事实不能用同一原理解释的是( )
A.加热碳酸氢铵晶体和氯化铵晶体都产生气体
B.漂白粉和双氧水都可用于漂白织物
C.臭氧和硫酸亚铁都可用于处理生活用水
D.向牛奶和豆浆中加入食醋都会出现絮凝物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某温度(t℃)时,水的Kw=10-13,则该温度(填 “大于”“小于”或“等于”)_________ 25℃,理由是_________,将此温度下pH =11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,
(1)若所得混合液为中性,则a∶b_________;
(2)若所得混合液的pH=2,则a∶b_________。
Ⅱ.25℃时,0.1mol·L-1的某一元酸HA在水中有0.1%发生电离,下列说法不正确的是(_____)
A.该溶液pH=4 B.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
C.此酸的电离平衡常数约为1×10-7 D.升高温度,溶液的pH增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com