
【题目】向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示。
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示。

容器 | 甲 | 乙 | 丙 |
容积 | 1L | 1L | 2L |
温度/℃ | T1 | T2 | T2 |
反应物 起始量 | 1molA 2molB | 1molA 2molB | 4molA 8molB |
下列说法正确的是
A. 由图可知T1<T2,且该反应为吸热反应
B. 前10min内甲、乙、丙三个容器中反应的平均速率:v(A)乙<v(A)甲< v(A)丙
C. 平衡时A的转化率a:a乙<a甲<a丙
D. T1时该反应的平衡常数K=7.2
【答案】D
【解析】A、对比甲和乙的图像,先达到平衡,说明反应速率快,温度高,即T2>T1,随着温度的升高,C的浓度降低,说明升高温度平衡向逆反应方向进行,即正反应是放热反应,故A错误;B、根据图像,前10min,丙的变化量大于乙中的变化量,因此v(A)丙>v(A)乙,甲中变化量等于乙中的变化量,因此v(A)甲等于v(A)乙,即 v(A)甲=v(A)乙<v(A)丙,故B错误;C、甲:A的转化率是1.5x/2×100%,乙:A的转化率是x/2×100%,丙:4x/(2×4)×100%,因此可以得出,a甲<a丙=a乙,故C错误;D、在相同的温度时,根据图中乙和丙两条曲线可知,平衡时曲线丙中C的浓度是乙曲线的2倍,而起始时A和B的浓度,容器丙的浓度是容器乙浓度的2倍,即容器丙中的压强是容器乙中2倍,而平衡没有移动,说明反应前后气体系数之和相等,即x=1,A(g)+B(g)![]() 2C(g)
2C(g)
起始浓度(mol·L-1) 1 2 0
变化浓度(mol·L-1) 0.75 0.75 1.5
平衡浓度(mol·L-1) 0.25 1.25 1.5 K=c2(C)/[c(A)×c(B)]=1.52/(0.25×1.25)=7.2,故D正确。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】实验室制取乙酸乙酯的主要步骤如下:
①在甲试管(如图)中加入2mL浓硫酸、3mL乙醇和2mL乙酸的混合溶液.
②按下图连接好装置(装置气密性良好)并加入混合液,用小火均匀地加热3~5min。
③待试管乙收集到一定量产物后停止加热,撤出试管乙并用力振荡,然后静置待分层。
④分离出乙酸乙酯层、洗涤、干燥。
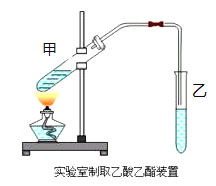
(1)写出制取乙酸乙酯的化学方程式:___________________________________。
(2)在反应未开始前,乙试管中所盛溶液为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气中CO2含量的增加会加剧温室效应,为减少其排放,需将工业生产中产生的CO2分离出来进行储存和利用。
(1)CO2与NH3反应可合成化肥尿素[化学式为CO(NH2)2]。
已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-159.5kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+116.5kJ/mol
③H2O(l)=H2O(g) ΔH=+44.0kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式:______________。
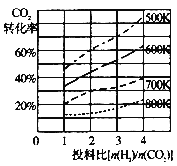
(2)CO2与H2也可用于合成甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。在体积可变的恒压密闭容器中压强为P时,该反应在不同温度、不同投料比时,达平衡时CO2的转化率如图一所示。
CH3OH(g)+H2O(g)。在体积可变的恒压密闭容器中压强为P时,该反应在不同温度、不同投料比时,达平衡时CO2的转化率如图一所示。
图一 图二 图三
①该反应的S 0,H 0(填“>”或“<”)。
②700K时,用平衡分压代替平衡浓度表示的化学平衡常数KP= 。
③若温度不变,减小反应物投料比[n(H2)/n(CO2)],K值 (填“增大”、“减小”或“不变”)。
④700K投料比[n(H2)/n(CO2)] = 2时,达平衡时H2的转化率为 。
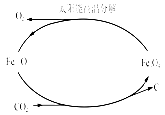
(3)利用太阳能和缺铁氧化物[如Fe0.9O]可将富集到的廉价CO2热解为碳和氧气,实现CO2再资源化,转化过程如图二所示,若用1mol缺铁氧化物[Fe0.9O]与足量CO2完全反应可生成 molC(碳)。
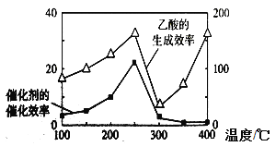
(4)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图三。如何解释图中250-400℃时温度升高与乙酸的生成速率变化的关系? 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是

A. XZ线上任意点均呈中性,pH=7
B. 两条曲线间任意点均有c(H+)·c(OH-)=Kw
C. M区域内任意点均有c(H+)<c(OH-)
D. 图中T1<T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项比较中前者高于(或大于或强于)后者的是
A. 金属Mg和金属Cu的空间利用率 B. BF3和CH4中心原子的价层电子对数
C. 邻羟基苯甲醛(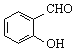 )和对羟基苯甲醛(
)和对羟基苯甲醛(![]() )的沸点 D. C-O和Si-O的键能
)的沸点 D. C-O和Si-O的键能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关原电池的说法中正确的是( )
A. 电极一定要由两种不同的金属组成
B. 电子流出的一极是正极
C. 两极均发生氧化还原反应
D. 由化学能转化为电能的装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于“摩尔”的理解正确的是( )
A.摩尔是国际单位制的一个基本物理量
B.摩尔是物质的量的单位,简称摩,符号为mol
C.摩尔可以把物质的宏观数量与微观粒子的数量联系起来
D.表示6.02×1023个粒子的集合体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将1mol H2和11.2 L O2混合,得到气体的体积为( )
A.12.2 L B.<22.4 L C.33.6 L D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某钴矿石的主要成分为Co2O3,同时含有少量Fe2O3、Al2O3、MnO、MgO、CaO等杂质。用该种钴矿石制取CoC2O4·2H2O的工艺流程如下:

①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形成沉淀时溶液的pH见下表:
![]()
(1)写出两条提高浸出速率所采取的措施_______、________。
(2)浸出过程中加入Na2SO3的主要目的是___________。
(3)沉淀1的成分是___________(写化学式)。
(4)在C1O3-和Co3+中,氧化性最强的是_____________。
(5)浸出液中加入NaC1O3所发生反应的离子方程式为_________。
(6)滤液II中加入萃取剂的作用是__________。
(7)“操作X”包括______和_____________。
(8)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。当加入过量NaF后,所得滤液中c(Mg2+):c(Ca2+)= 0.67,则Ksp(MgF2)=_________(已知Ksp(CaF2)=1.10×10-10)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com