
【题目】以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制比的过程如图所示。下列叙述正确的是( )

A.H2的标准燃烧热△H<-(△H1+△H2)
B.过程I适当降低反应体系温度,反应更有利
C.过程II中3mo1FeO(s)的总能量高于lmolFe3O4(s)
D.增加铁氧化合物的质量可以显著提高循环制H2的速率
【答案】A
【解析】
A.根据图示,过程Ⅰ的热反应方程式为:Fe3O4(s) = 3FeO(s) +![]() O2(g) ΔH1;过程Ⅱ的热反应方程式为:3FeO(s)+H2O(g) = Fe3O4(s)+ H2(g) ΔH2;根据盖斯定律:-(过程Ⅰ+过程Ⅱ) 可得:H2(g) +
O2(g) ΔH1;过程Ⅱ的热反应方程式为:3FeO(s)+H2O(g) = Fe3O4(s)+ H2(g) ΔH2;根据盖斯定律:-(过程Ⅰ+过程Ⅱ) 可得:H2(g) +![]() O2(g)= H2O(g) ΔH3= (ΔH1+ΔH2);H2的标准燃烧热为生成液态水时放出的热量,由气态水变为液态水放热,放出的热量越多,焓变越小,则ΔH<ΔH3,即ΔH<(ΔH1+ΔH2),故A正确;
O2(g)= H2O(g) ΔH3= (ΔH1+ΔH2);H2的标准燃烧热为生成液态水时放出的热量,由气态水变为液态水放热,放出的热量越多,焓变越小,则ΔH<ΔH3,即ΔH<(ΔH1+ΔH2),故A正确;
B.过程Ⅰ适当降低反应体系温度,反应速率变慢,生产效率降低,故B错误;
C.根据图示,由过程Ⅱ中无法比较3molFeO(s)的总能量与1mol Fe3O4(s)的高低,实际上1mol Fe3O4原子数目更多,总能量更高,故C错误;
D.铁氧化物为固体,增加铁氧化合物的质量,没有改变反应物的浓度,不能显著提高循环制H2的速率,故D错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】高温下,某反应达到平衡,平衡常数K=![]() 。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
A. 该反应的焓变为正值
B. 恒温下,增大压强,H2浓度一定减小
C. 升高温度,逆反应速率减小
D. 该反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、Co、Ni均为第Ⅷ族元素,它们的化合物在生产、生活中有着广泛的应用。
(1)基态Fe原子中,电子填充的能量最高的能级符号为__。
(2)在空气中FeO稳定性小于Fe2O3,从电子排布的角度分析,其主要原因是__。
(3)铁氰化钾{K3[Fe(CN)6])}溶液是检验Fe2+常用的试剂。lmol[Fe(CN)6]3-含σ键的数目为__。
(4)Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+的配位数是__。配体N3-中心原子的杂化类型为__。CoO的熔点是1935℃,CoS的熔点是1135℃,试分析CoO的熔点较高的原因__。
(5)NiO的晶胞结构如图所示,其中原子坐标参数A为(0,0,0),B为(1,1,0),则C原子坐标参数为__。
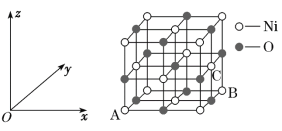
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.298K时,pH=10的氨水稀释100倍,所得溶液的pH=8
B.298K时,pH=9的CH3COONa溶液和pH=5的盐酸等体积混合,溶液显中性
C.HClO与HF的混合溶液中c(H+)=![]()
D.室温下,等pH的盐酸和氯化铵两种溶液,导电能力相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.一定条件下,合成氨反应中有0.5molN2发生反应,则反应中转移电子数为3NA
B.10克环己烷与2-丙醇的混合液中,碳元素的质量分数为72%,则其中所含的氧原子数目为![]() NA
NA
C.过量铜与含0.4molHNO3的浓硝酸反应,则反应中电子转移数为0.2NA
D.常温常压下有28g单晶硅晶体,则其中所含的Si—Si键数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有如下3个热化学方程式:H2(g)+![]() O2(g)= H2O(g) △H=a kJ/mol,H2(g)+
O2(g)= H2O(g) △H=a kJ/mol,H2(g)+ ![]() O2(g)= H2O(l) △H=b kJ/mol,2H2(g) +
O2(g)= H2O(l) △H=b kJ/mol,2H2(g) + ![]() O2(g)= 2H2O(l) △H=c kJ/mol,关于它们的下列表述正确的是:
O2(g)= 2H2O(l) △H=c kJ/mol,关于它们的下列表述正确的是:
A.它们都是吸热反应B.a、b、c均为正值C.a=bD.c=2b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸埃洛替尼(I)是一种抑制癌细胞增殖的药物,其合成路线如图:

已知:

(l)下列说法不正确的是___。
A.上述流程中的反应中,D到E为取代反应,E到F为还原反应
B.一定条件下I最多可以和9molH2反应
C.D的氢核磁共振谱图中有7组峰
D.G可以发生水解反应
(2)写出H的结构简式:___。
(3)写出F生成G的化学方程式:___。
(4)有机物X的分子组成比C发生消去反应后的产物多2个“CH2”,请写出X符合下列条件的同分异构体:___。
①X分子结构中不含碳碳双键和羟基②X核磁共振氢谱有三组峰
(5)以A和甲醇为原料合成B,请设计合成路线___(用流程图表示,无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)以石灰石为原料通过系列反应将硫元素以CaSO4的形式固定,从而降低SO2的排放。相关反应的热化学方程式如下:CaSO4 (s)+CO (g) ![]() CaO(s)+SO2 (g)+CO2 (g) △H1= +218.4kJ·mol-1(反应Ⅰ),CaSO4 (s) +4CO (g)
CaO(s)+SO2 (g)+CO2 (g) △H1= +218.4kJ·mol-1(反应Ⅰ),CaSO4 (s) +4CO (g) ![]() CaS(s) +4CO2(g)△H2=﹣175.6kJ·mol-1 (反应Ⅱ),结合反应Ⅰ、Ⅱ写出CaSO4 (s)与CaS (s) 反应的热化学反应方程式_______。
CaS(s) +4CO2(g)△H2=﹣175.6kJ·mol-1 (反应Ⅱ),结合反应Ⅰ、Ⅱ写出CaSO4 (s)与CaS (s) 反应的热化学反应方程式_______。
(2)NO2、SO2气体混合存在氧化物间的相互转化平衡:NO2(g)+SO2(g)![]() SO3(g)+NO(g),某活动小组对此反应进行研究实验
SO3(g)+NO(g),某活动小组对此反应进行研究实验
实验内容 | 实验现象 | 结论 | |
① | 将充有NO2、SO2气体的密闭烧瓶放入热水中 | 气体红棕色加深,一段时间后颜色不再变化 | △H___0 (填>、<或=) |
② | 在针筒中抽入5mL NO2和5mL SO2气体,封闭针筒前端,充分反应后,将活塞迅速推至5mL处 | 气体红棕色加深并保持不变 | 平衡____(填向左、向右或不)移动 |
③ | 在充有NO2、SO2混合气体的恒容容器中,达平衡后继续通入SO2气体 | _____ | 平衡向右移动,SO2的转化率____(填增大、减小或不变) |
(3)工业上用活性炭还原法处理NO,有关反应为:C(s) +2NO(g)![]() N2(g) +CO2(g)。为了提高NO的转化率,下列的措施可行的是___。
N2(g) +CO2(g)。为了提高NO的转化率,下列的措施可行的是___。
A.再加入一定量的碳 B.增大压强 C.用碱液吸收气体 D.使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】厌氧氨化法(Anammox)是一种新型的氨氮去除技术,原理如图所示。下列说法正确的是( )

A.1molNH4+所含的电子总数与1mol-OH所含的电子总数相同
B.过程II、III、IV均为还原反应
C.用该方法每处理1molNH4+需要的NO2-为0.5mol
D.1mol联氨(N2H4)中含有5mol共价键,均为σ键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com