
【题目】高温下,某反应达到平衡,平衡常数K=![]() 。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
A. 该反应的焓变为正值
B. 恒温下,增大压强,H2浓度一定减小
C. 升高温度,逆反应速率减小
D. 该反应为放热反应
 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L1盐酸与50 mL 0.55 mol·L1 NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
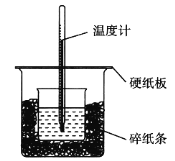
(1)从实验装置上看,图中尚缺少的一种玻璃用品是______________________________。
(2)烧杯间填满碎纸条的作用是______________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值__________(填”偏大”“偏小”或”无影响”)。
(4)实验中改用60 mL 0.50 mol·L1盐酸跟50 mL 0.55 mol·L1 NaOH溶液进行反应,与上述实验相比,所放出的热量__________(填”相等”或”不相等”),所求中和热__________(填”相等”或”不相等”),简述理由:_________________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会__________(填”偏大”“偏小”或”无影响”,下同);用50 mL 0.50 mol·L1 NaOH溶液进行上述实验,测得的中和热的数值会__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质中只有A、B、C三种单质,A的焰色反应为黄色,主要以G形式存在于海水中,F是一种淡黄色的固体,H是一种常见的无色液体,I是造成温室效应的“元凶”,各物质间的转化关系图如下:
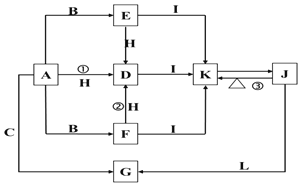
请按要求书写:
(1)反应①的离子方程式: ____________________________________;
(2)物质K与物质L等物质的量离子方程式:___________________________;
(3)物质F转化为D的离子方程式:___________________________________;
(4)物质G向物质J转化的化学方程式:_______________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向a L密闭容器中加入1 mol X气体和2 mol Y气体,发生如下反应:X(g)+2Y(g)![]() 3Z(g)。此反应达到平衡的标志是
3Z(g)。此反应达到平衡的标志是
A. 容器内压强不随时间变化
B. 容器内各物质的浓度不随时间变化
C. 容器内X、Y、Z的浓度之比为l∶2∶3
D. 单位时间消耗0.1 mol X同时生成0.3 mol Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究大气中含硫化合物(主要是SO2和H2S)的转化具有重要意义。
(1)高湿条件下,写出大气中SO2转化为HSO3-的方程式: 。
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如下:
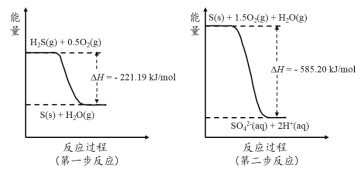
1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为 。
(3)二氧化硫—空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置示意图如下:
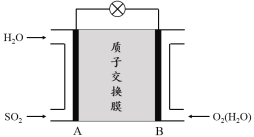
① 质子的流动方向为 (“从A到B”或“从B到A”)。
② 负极的电极反应式为 。
(4)燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关键。SO2烟气脱除的一种工业流程如下:
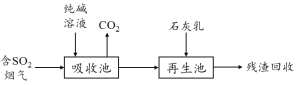
用纯碱溶液吸收SO2将其转化为HSO3-,反应的离子方程式是 。
若石灰乳过量,将其产物再排回吸收池,其中可用于吸收SO2的物质的化学式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子反应方程式正确的是( )
A. 硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:2Fe2++2H++H2O2= 2Fe3++2H2O
B. 电解饱和食盐水:2Cl-+2H2O![]() H2↑+C12↑+2OH-
H2↑+C12↑+2OH-
C. 铁和稀硝酸反应:Fe+ 2H+=Fe2++ H2↑
D. 硫酸氢钠溶液中逐滴加入氢氧化钡溶液直至溶液呈中性: H++ SO42- + OH-+ Ba2+ = BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:

(1)氢氧燃料电池能量转化的主要形式是____________________________________________,在导线中电子流动方向为________(用a、b表示)。
(2)负极反应式为________________________________________________________________。
(3)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2===2LiH Ⅱ.LiH+H2O===LiOH+H2↑
①反应Ⅰ中的还原剂是________,反应Ⅱ中的氧化剂是________。
②金属锂吸收的氢气与放出的氢气的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下:
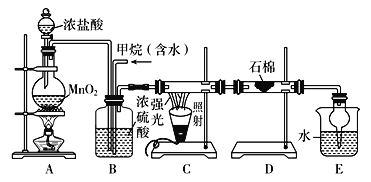
根据设计要求回答:
(1)B装置有三种功能:①控制气流速度; ②均匀混合气体; ③____________。
(2)设![]() =x,若理论上欲获得最多的氯化氢,则x取值范围________。
=x,若理论上欲获得最多的氯化氢,则x取值范围________。
(3)D装置的石棉中均匀混有KI粉末,其作用是______________。
(4)E装置的作用是________(填编号)。
A 收集气体 B 吸收氯气
C 防止倒吸 D 吸收氯化氢
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式:_______________________________________。
(6)E装置中除生成盐酸外,还含有有机物,从E中分离出有机物的最佳方法为________。该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为________(填编号)。
a CH4 b CH3Cl c CH2Cl2 d CHCl3 e CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制比的过程如图所示。下列叙述正确的是( )

A.H2的标准燃烧热△H<-(△H1+△H2)
B.过程I适当降低反应体系温度,反应更有利
C.过程II中3mo1FeO(s)的总能量高于lmolFe3O4(s)
D.增加铁氧化合物的质量可以显著提高循环制H2的速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com