
【题目】除去镁粉中混有的少量铝粉,可选用的试剂是 ( )
A. 稀盐酸 B. 氢氧化钠溶液 C. 浓氨水 D. 硝酸铜溶液
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图所示,烧杯甲中盛有少量液态冰醋酸,烧杯乙中盛有NH4Cl晶体,在烧杯乙中再加入适量氢氧化钡晶体[Ba(OH)2·8H2O],搅拌,可观察到冰醋酸逐渐凝结为固体。下列有关判断正确的是

A.NH4Cl与Ba(OH)2·8H2O反应的焓变(ΔH)小于0
B.反应物的总能量高于生成物的总能量
C.反应中有热能转化为产物内部的能量
D.反应中断裂的化学键只有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用足量镁粉与一定量的某浓度的盐酸反应来制得氢气。由于反应速率太快,不易操作。为减慢反应速率,同时又不影响生成H2的总量,可向盐酸中加入的物质是
A.CH3COONa固体 B.NaOH溶液 C.(NH4)2SO4粉末 D.K2SO4固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W代表原子序数依次增大的四种短周期主族元素,它们满足以下条件:①在元素周期表中,Z与Y、W均相邻;②X、Y、W分别位于不同周期;③Y、Z、W三种元素的原子最外层电子数之和为17.下列说法正确的是 ( )
A. X、Y、Z既能形成离子化合物,又能形成共价化合物
B. 元素的原子半径由小到大的顺序为r(Y)<r(Z)
C. X与其余三种元素之间形成的核外电子总数为10的微粒只有4种
D. H2Z的熔点比H2W高,是因为H2Z分子内存在氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向密闭容器中充入物质A和B,发生反应aA(g)+bB(g)![]() cC(g)。反应过程中,物质A的体积分数
cC(g)。反应过程中,物质A的体积分数
和C的体积分数随温度(T)的变化曲线如图所示。下列说法正确的是
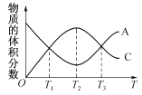
A.该反应在T1、T3温度时达到化学平衡 B.该反应在T2温度时达到化学平衡
C.该反应的逆反应是放热反应 D.升高温度,平衡会向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。参照元素在表中的位置,请用化学用语回答下列问题:
族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ⑤ | ⑥ | ⑦ | |||||
3 | ② | ③ | ④ | ⑧ | ||||
4 | ⑨ | |||||||
5 | ⑩ |
(1)⑨的最高价含氧酸的化学式为_________。
(2)①和⑦两种元素的原子按1:1组成的常见化合物的结构式为_________。
(3)③④⑦⑧的简单离予半径由大到小的顺序为_________。(用离子符号表示)
(4)②④的最高价氧化物的水化物之间发生反应的离予方程式_________。
(5)用电子式表示③和⑨组成的化介物的形成过程_________。
(6)海带中含有⑩元素,海带灰中含有该元素的简单阴离子。在硫酸酸化下,可用双氧水将其氧化为单质。写出该反应的离子方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中主要含有Na+、K+、Mg2+、Ca2+、Cl-、Br-、SO42-、HCO3-、CO32-等离子,火力发电时排放的烟气可用海水脱硫,其工艺流程如下图所示,下列说法错误的是

A.海水pH约为8的原因主要是天然海水含CO32-、HCO3-
B.吸收塔中发生的反应有SO2+H2O![]() H2SO3
H2SO3
C.氧化主要是氧气将HSO3-、SO32-、H2SO3氧化为SO42-
D.经稀释“排放”出的废水中,SO42-浓度与海水相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从人类利用金属的历史看,先是青铜器时代,而后是铁器时代,铝的利用是近百年的事,造成这个先后顺序事实的最主要因素是( )
A. 地壳中金属元素的含量 B. 金属的延展性
C. 金属的导电性 D. 金属冶炼的难易程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于溶液的酸碱性说法正确的是( )
A.c(H+)很小的溶液一定呈碱性B.pH = 7的溶液一定呈中性
C.c(H+)=c(OH-)的溶液一定呈中性D.不能使酚酞试液变红的溶液一定呈碱性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com