
【题目】取一块用砂纸打磨过的铝箔在空气中加热至熔化,下列说法不正确的是
A. 铝表面失去光泽 B. 剧烈燃烧,火星四射,生成黑色固体
C. 熔化的铝不滴落 D. 在加热熔化过程中生成了氧化铝
科目:高中化学 来源: 题型:
【题目】我国科学家最近发现一种只有六个中子构成的粒子,这种粒子称为“六中子”,也有人称之为“零号元素”。下列有关“六中子”粒子的说法不正确的是
A.该粒子不显电性B.该粒子质量数为6
C.在周期表中与氢元素占同一位置D.该粒子质量比氢原子的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池是常用的化学电源,其电极材料分别是Pb和PbO2,电解液为稀硫酸。放电时,该电池总反应式为:Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O。请根据上述情况判断:
2PbSO4+2H2O。请根据上述情况判断:
(1)该蓄电池的负极材料是_________,放电时发生_________(填“氧化”或“还原”)反应。
(2)该蓄电池放电时,电解质溶液的酸性_________(填“增大”、“减小”或“不变”),电解质溶液中阴离子移向_________(填“正”或“负”)极。
(3)已知硫酸铅为不溶于水的白色固体,生成时附着在电极上。试写出该电池放电时,正极的电极反应_______________________________________(用离子方程式表示)。
(4)氢氧燃料电池具有启动快、效率高等优点,其能量密度高于铅蓄电池。若电解质为H2SO4溶液,则氢氧燃料电池的正极反应式为__________________________________。该电池工作时,外电路每流过1×103 mol e-,消耗标况下氧气_________m3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应过程中能量变化的说法正确的是

A. 图中a、b曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g) ΔH<0使用和未使用催化剂时,反应过程中的能量变化
B. 己知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2。则ΔH1>ΔH2
C. 同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
D. 在一定条件下,某可逆反应的ΔH=+100kJ·mol-1,则该反应正反应活化能比逆反应活化能大100kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关浓硫酸、浓盐酸、浓硝酸的认识不正确的是
A.浓硫酸、浓硝酸与金属反应时,分别是S、N得电子
B.蔗糖与浓硫酸混合后,白色蔗糖固体逐渐变成黑色疏松的碳,体现了浓硫酸的脱水性
C.浓盐酸、浓硝酸具有挥发性,而浓硫酸难挥发
D.常温下,浓硫酸或浓HNO3中投入Fe片,均会产生大量的气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国企业华为宣布:利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2![]() C6+LiCoO2,其工作原理如图。下列关于该电池的说法正确的是
C6+LiCoO2,其工作原理如图。下列关于该电池的说法正确的是

A. 该电池若用隔膜可选用阴离子交换膜
B. 石墨烯电池的优点是提高电池的储锂容量进而提高能量密度
C. 放电时,LiCoO2极发生的电极反应为:LiCoO2-xe-=Li1-xCoO2+xLi+
D. 对废旧的该电池进行“放电处理”让Li+嵌入石墨烯中而有利于回收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三位同学分别用下图所示的三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气。请你参与探究,并回答下列问题:
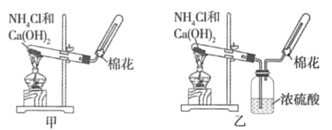
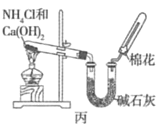
(1)三位同学制取氨气的化学方程式为__________。
(2)三位同学都用向下排空气法收集氨气,而不用排水法,其原因是__________(填序号)。
A.氨气难溶于水 B.氨气极易溶于水
C.氨气密度比空气大 D.氨气密度比空气小
(3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨气(他们的实验操作都正确),你认为没有收集到氨气的同学是__________(填“甲”、“乙”或“丙”),收集不到氨气的主要原因是__________________________。
(4)检验氨气是否收集满的方法是__________(填序号)。
A.闻到有氨气逸出 B.用湿润的红色石蕊试纸在试管口检验,发现试纸变蓝
C.棉花被气体冲出 D.用湿润的蓝色石蕊试纸在试管口检验,发现试纸变红
(5)三位同学都认为他们的实验装置也可用于加热碳酸氢铵固体制取纯净的氨气,你判断能够达到实验目的的同学是__________(填“甲”、“乙”或“丙”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷是一种理想的洁净燃料,利用甲烷与水反应制备氢气,因原料廉价,具有推广价值。该反应为CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H>0
CO(g)+3H2(g) △H>0
(1)800℃时,反应的化学平衡常数K=l.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如表。则此时正、逆反应速率的关系是____。
CH4 | H2O | CO | H2 |
3.0molL-1 | 8.5molL-1 | 2.0molL-1 | 2.0molL-1 |
(2)为了探究温度、压强对上述化学反应速率的影响,某同学设计了以下三组对比实验(温度为360℃或480℃、压强为101 kPa或303 kPa,其余实验条件见下表)。
实验序号 | 温度/℃ | 压强/kPa | CH4初始浓度/ molL1 | H2O初始浓度/ molL1 |
1 | 360 | p | 2.00 | 6.80 |
2 | t | 101 | 2.00 | 6.80 |
3 | 360 | 101 | 2.00 | 6.80 |
表中t=____,P=_____;设计实验2、3的目的是________________;
实验l、2、3中反应的化学平衡常数的大小关系是____(用K1、K2、K3表示)。
(3)一定温度下,在容积2L且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容 器 | 甲 | 乙 |
反应物投入量 | 1molCH4、1molH2O | a molCH4、a molH2O、b molCO、c molH2 |
经测定甲容器经过5min达到平衡,平衡后甲中气体的压强为开始的1.2倍,甲容器中该反应在5min内的平均速率υ(H2)=_______,若要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则b的取值范围为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“即食即热型快餐”适合外出时使用,其内层是用铝箔包裹并已加工好的真包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线使这两种化学物质发生反应,放出的热量便可对食物进行加热,这两包化学物质最适合的选择是
A.浓硫酸和水B.生石灰和水C.熟石灰和水D.氯化钠和水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com