
【题目】甲烷是一种理想的洁净燃料,利用甲烷与水反应制备氢气,因原料廉价,具有推广价值。该反应为CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H>0
CO(g)+3H2(g) △H>0
(1)800℃时,反应的化学平衡常数K=l.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如表。则此时正、逆反应速率的关系是____。
CH4 | H2O | CO | H2 |
3.0molL-1 | 8.5molL-1 | 2.0molL-1 | 2.0molL-1 |
(2)为了探究温度、压强对上述化学反应速率的影响,某同学设计了以下三组对比实验(温度为360℃或480℃、压强为101 kPa或303 kPa,其余实验条件见下表)。
实验序号 | 温度/℃ | 压强/kPa | CH4初始浓度/ molL1 | H2O初始浓度/ molL1 |
1 | 360 | p | 2.00 | 6.80 |
2 | t | 101 | 2.00 | 6.80 |
3 | 360 | 101 | 2.00 | 6.80 |
表中t=____,P=_____;设计实验2、3的目的是________________;
实验l、2、3中反应的化学平衡常数的大小关系是____(用K1、K2、K3表示)。
(3)一定温度下,在容积2L且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容 器 | 甲 | 乙 |
反应物投入量 | 1molCH4、1molH2O | a molCH4、a molH2O、b molCO、c molH2 |
经测定甲容器经过5min达到平衡,平衡后甲中气体的压强为开始的1.2倍,甲容器中该反应在5min内的平均速率υ(H2)=_______,若要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则b的取值范围为________。
【答案】v正> v逆480303探究温度对化学反应速率的影响K1=K3<K20.06mol·L-1·min-10.2<b≤1
【解析】
(1)此时的浓度商为![]() =0.63<平衡常数K=1,所以反应向正反应进行,即v(正)>v(逆),故答案为:v(正)>v(逆);
=0.63<平衡常数K=1,所以反应向正反应进行,即v(正)>v(逆),故答案为:v(正)>v(逆);
(2)三组实验条件要求温度为360℃或480℃、压强为101kPa或303kPa,采取控制变量法,探究温度、压强对化学反应速率的影响,由表可知t为480,p为303;
对比实验2、3,只有温度不同,其它条件相同,所以实验2、3的目的是探究温度对化学反应速率的影响;实验1、3温度相同,平衡常数相同,即K1=K3,比较实验1、2,实验2中温度高,温度升高,平衡向吸热方向移动,该反应为吸热反应,所以平衡向正反应方向移动,平衡常数增大,即K2>K1,所以K1=K3<K2,故答案为:480;303;探究温度对化学反应速率的影响;K1=K3<K2;
(3)设反应的甲烷的物质的量为x,
CH4(g)+H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
起始(mol)1 1 0 0
反应(mol)x x x 3x
平衡(mol)1-x 1-x x 3x
平衡后甲中气体的压强为开始的1.2倍,即物质的量为开始时的1.2倍,则(1mol-x)+(1mol-x)+x+3x=(1 mol +1 mol)×1.2,解得x=0.2mol,甲容器中该反应在5min内的平均速率υ(H2)=![]() =0.06mol·L-1·min-1;若要使平衡后乙与甲中相同组分的体积分数相等,即甲乙等效,由于该反应前后气体的物质的量不等,在等温等体积时,需要转换到方程式一边,物质的量分别相等,则b的最大值为1mol,起始时要维持化学反应向逆反应方向进行,则b要大于0.2mol,因此0.2<b≤1,故答案为:0.06mol·L-1·min-1;0.2<b≤1。
=0.06mol·L-1·min-1;若要使平衡后乙与甲中相同组分的体积分数相等,即甲乙等效,由于该反应前后气体的物质的量不等,在等温等体积时,需要转换到方程式一边,物质的量分别相等,则b的最大值为1mol,起始时要维持化学反应向逆反应方向进行,则b要大于0.2mol,因此0.2<b≤1,故答案为:0.06mol·L-1·min-1;0.2<b≤1。


科目:高中化学 来源: 题型:
【题目】光气(COC12熔点为-118℃,沸点为8.2℃,微溶于水,易溶于甲苯等有机溶剂)可作为化学武器的成分,其制备实验装置如图所示(夹持装置已省略)。
已知:3CCl4+2H2SO4(浓)![]() 3COCl2↑+4HCl+S2O5Cl2。下列说法正确的是
3COCl2↑+4HCl+S2O5Cl2。下列说法正确的是
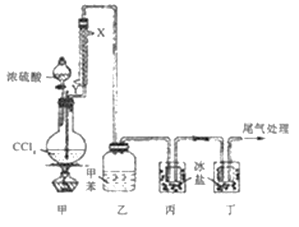
A. 装置组装连接后,第一步操作通入冷凝水,然后才能加热
B. 自来水从冷凝管的X口通入,且被冷凝的物质是CCl4
C. 装置乙中可收集到光气的甲苯溶液,装置丙、丁均可收集到液态光气
D. 可将装置丁的尾气通过导管直接通入NaOH溶液中进行尾气处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一块用砂纸打磨过的铝箔在空气中加热至熔化,下列说法不正确的是
A. 铝表面失去光泽 B. 剧烈燃烧,火星四射,生成黑色固体
C. 熔化的铝不滴落 D. 在加热熔化过程中生成了氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法正确的是
A.检查酒驾时,CrO3被酒精氧化成Cr2 (SO4)3
B.向海水中加入明矾可以使海水淡化
C.碳海绵吸收泄露的原油时发生了化学变化
D.氧化钙可用作食品干燥剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种不同物质之间具有如图所示转化关系(反应条件及部分产物已略去)。下列有关物质的推断不正确的是 ( )

选项 | 假设 | 结论 |
A | A为NaOH溶液 | D可能是CO2 |
B | B为CO | C可能是CO2 |
C | C为FeCl2 ,D为Fe | A可能是盐酸 |
D | C为SO2 | A可能是H2S |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四组实验描述不正确的是
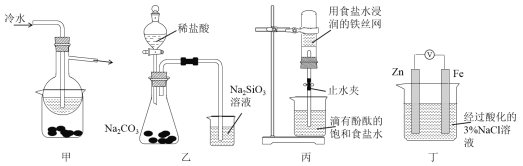
A. 加热甲装置中的烧杯可以分离SiO2和NH4Cl
B. 利用装置乙可证明非金属性强弱:Cl>C>Si
C. 打开丙中的止水夹,一段时间后,可观察到烧杯内溶液上升到试管中
D. 向丁中铁电极区滴入2滴铁氰化钾溶液,一段时间后,烧杯中不会有蓝色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验基本操作或实验注意事项中,主要是基于实验安全考虑的是
A. 可燃性气体的验纯 B. 滴管不能交叉使用
C. 容量瓶在使用前进行检漏 D. 实验剩余的药品不能放回原试剂瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
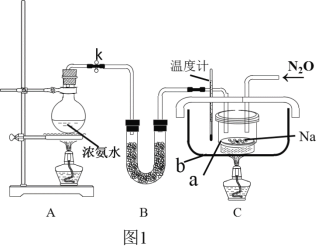
【题目】叠氮化钠(NaN3)是一种应用广泛的化工产品,可用于合成抗生素头孢菌素药物的中间体,汽车安全气囊等。
Ⅰ.实验室制备NaN3
(1)实验原理:
①把氨气通入熔融金属钠反应制得氨基钠(NaNH2),该反应的化学方程式为____________。
②将生成的NaNH2与N2O在210℃-220℃下反应可生成NaN3、NaOH和气体X,该反应的化学方程式为2NaNH2+N2O═NaN3+NaOH+X,实验室检验X气体使用的试纸是湿润的______。
(2)实验装置(图1)、步骤如下,回答下列问题:
已知:i)NaN3是一种易溶于水的白色晶体,微溶于乙醇,不溶于乙醚;
ii)NaNH2的熔点为210℃,沸点为400℃,在水溶液中易水解。
①组装仪器检查装置气密性后,装入药品。装置B中盛放的药品是_______________。
②实验过程应先点燃___(填“A”或“C”)处的酒精灯,理由是_______________________。
③让氨气和熔化的钠充分反应后,停止加热A并关闭止水夹k。向装置C中b容器内充入加热介质植物油并加热到210℃-220℃,然后按图通入N2O;
④装置C反应完全结束后,冷却,取出a中的混合物进行以下操作,得到NaN3固体:

操作II的目的是____________;
操作IV中选用的洗涤试剂最好的是_____。
A.水 B.乙醇 C.乙醇水溶液 D.乙醚
(3)图中仪器a用不锈钢材质的而不用玻璃的,其主要原因是____________________。
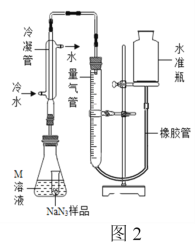
II.产品NaN3纯度测定
精确称量0.150 g NaN3样品,设计如图2所示装置,连接好装置后使锥形瓶倾斜,使小试管中的NaN3样品与M溶液接触,测量产生的气体体积从而测定其纯度。
已知2 NaN3→ 3N2(NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热。
(4)使用冷水冷凝的目的是______。对量气管读数时,反应前后都需要进行的操作是______。
(5)常温下测得量气管读数为60.0 mL(N2的密度为1.40 g/L)计算NaN3样品的纯度为______。(保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25C时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n随时间1的变化如图1所示,已知反应达到平衡后,降低温度,A的转化率将增大。

(1)根据图1数据。写出该反应的化学方程式:_____________;此反应的平衡常数表达式为K=_________,从反应开始到第一次平衡时的平均速率v(A)为________。
(2)在5~7min内,若K值不变,则此处曲线变化的原因是_________。
(3)图2表示此反应的反应速率v和时间t的关系,t3、t5、t6时刻各改变一个且互不相同的条件,各阶段的平衡常数如下表所示。K1、K2、K3、K4之间的关系为________(用“>”“<”或“=”连接)。A的转化率最大的一段时间是___________。
t2~t3 | t4~t5 | t5~t6 | t7~t8 |
K1 | K2 | K3 | K4 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com