
【题目】由乙炔、苯、乙醛组成的混合物,经测定其中碳元素质量分数为36%,则混合物中氧元素的质量分数为
A. 44% B. 54. 22% C. 39.12% D. 无法计算
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在盐类发生水解的过程中,下列说法中正确的是( )
A. 盐的水解不属于离子反应B. 溶液的pH一定发生改变
C. 水的电离程度增大D. 是中和反应的逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101 kPa条件下,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5 kJ/mol、285.8 kJ/mol、870.3 kJ/mol,则2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为( )
A.-488.3 kJ/mol B.+488.3 kJ/mol
C.-191 kJ/mol D.+191 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:将Cl2通人适量KOH溶液,产物中可能有KC1、KClO、KC1O3,且![]() 的值与温度高低有关.当n(KOH)=amol时,下列有关说法错误的是( )
的值与温度高低有关.当n(KOH)=amol时,下列有关说法错误的是( )
A. 若某温度下,反应后![]() =11,则溶液中
=11,则溶液中
B. 参加反应的氯气的物质的量等于0. 5amol
C. 改变温度,反应中转移电子的物质的量ne的范围:![]() amol≤ne≤
amol≤ne≤![]() amol
amol
D. 改变温度,产物中KC1O3的最大理论产量为![]() amol
amol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,几种弱酸的电离常数如下:
弱酸化学式 | HNO2 | CH3COOH | HCN | H2CO3 |
电离常数 | 5.1×10-4 | 1.8×10-5 | 6.2×10-10 | K1=4.4×10-7 K2=4.7×10-11 |
(1)根据上表数据填空:
①物质的量浓度相同的四种酸,其pH由大到小的顺序是___________ (用化学式填写)。
②分别向等体积、相同pH的HCl溶液和CH3COOH溶液中加入足量的Zn粉,反应刚开始时产生H2的速率:v(HCl)______v(CH3COOH)(填“=”、“>”或“<”下同),反应完全后,所得氢气的质量:m(H2)盐酸_______m(H2)醋酸。
③将0.2 mol/L HCN溶液与0.1 mol/L Na2CO3溶液等体积混合,发生反应的化学方程式为___________________________。
(2)体积均为10 mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1000 mL,稀释过程中溶液pH变化如图所示。稀释后,HX溶液中水电离的c(H+)___醋酸溶液中水电离的c(H+) ;电离常数Ka(HX)___Ka(CH3COOH)(填“>”、“=”或“<”)。
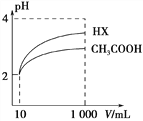
(3)CO32- 、 NO2- 、CN-、CH3COO-结合H+的能力由强到弱的顺序为_______________________(用离子符号表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于胶体,下列说法正确的是( )
A.胶体的聚沉是化学变化
B.含有0.01mol FeCl3的溶液制成的胶体中,胶体粒子的数目约为6.02×1021个
C.胶体的介稳性与胶体带有电荷有关
D.NaCl晶体既可制成溶液又可制成胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、1.01×105Pa下,将22gCO2通入到750mL1.0mol/L的NaOH溶液中充分反应,放出xkJ热量。已知该条件下,1mol CO2通入到2L1.0mol/LNaOH溶液中充分反应,放出y kJ的热量.则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确为
A. CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(2y-x)kJ/mol
B. CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(4x-y)kJ/mol
C. CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(2x-y)kJ/mol
D. CO2(g)+NaOH(aq)=2NaHCO3(aq)△H=-(8x-2y)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是一种常用的化工原料。实验室制备溴苯的实验步骤如下:

步骤1:在a中加入15 mL苯和少量铁屑,再将b中4.0 mL液溴慢慢加入到a中,充分反应。,有___________(填现象)产生; 将b中的液溴慢慢加入到a中,而不能快速加入的原因是___________,继续滴加液溴滴完。装置d的作用是___________________;
步骤2:向a中加入10 mL水,然后________(填操作名称)除去未反应的铁屑。
步骤3:滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤,分液得粗溴苯。NaOH溶液洗涤的作用是____________;
步骤4:向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤即得粗产品。加入氯化钙的目的是______________;
已知苯、溴苯的有关物理性质如上表:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
在水中的溶解度 | 微溶 | 微溶 | 微溶 |
(1)实验装置中,仪器c的名称为_____,作用是冷凝回流,回流的主要物质有___________________(填化学式)
(2)步骤4得到的粗产品中还含有杂质苯,,则要进一步提纯粗产品,还必须进行的实验操作名称是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与实验相关的叙述不正确的是
A. 蒸发完成时,用坩埚钳把蒸发皿移至实验桌上冷却
B. 乙酸乙酯的制备中,长导管不能伸到饱和碳酸钠溶液中
C. 分液操作时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出
D. 配制一定物质的量浓度的溶液,定容时仰视刻度,溶液浓度偏小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com